怎样配平有机化学方程式
时间:2020-03-13 17:02 来源:未知 作者:贾珍贵 点击:次 所属专题: 有机反应方程式配平
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、有机化合物中元素化合价的确定
1.由常见元素的化合价判断
一般氢为+1价,氧为—2价,碱金属为+1价,碱土金属为+2价。
如CH4中,H为+1,则碳为—4价;HCOOH中,氢为+1价,氧为—2价,则碳为+2价。
2.单碳节为零:
有机物是含碳化合物,分子中有较长的碳链,碳链上每个碳的化合物不是相等的,碳碳间共用电子对无偏移,对化合价的贡献为零。因此,可以每个碳为独立的单元,该碳节中各元素的化合价的代数和为零,由此判断各元素和碳的化合价。有机反应通常也在局部发生,配平时只要知道一个或几个碳节中元素的化合价即可。
如CH3—CHO,氢为+1价,氧为—2价,醛基中碳的化合价为+1
3.电子对偏移法:
两种不同原子化合时,电子对偏向吸引电子能力强的一方,偏向一对电子显-1价,偏向几对就显负几价,偏离几对电子就显正几价。
运用化合价升降法配平,正确判断元素的化合价是配平的前提,有机物中确定元素化合价的方法有以上三种途径。有时三种途径并用才能确定元素的化合价。
二、有机化学方程式的配平
1.基准分子整体升降法
找出反应物一个分子化合价升高或降低总数,再据化合价升降守恒确定反应物分子化学计量数,最后由质量守恒观察配平生成物的化学计量数。
[例1] 吡咯的燃烧:
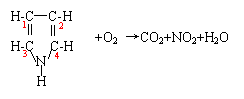
[分析] 1、2号C:(—1→+4)×2,升高5×2
3、4号C:(0→+4)×2,升高4×2
N:—3→+4,升高7
一个吡咯分子共升高25,一个O2分子在反应中降低4=(0→—2)×2,依据氧化还原反应中化合价升降总数相等,则:25×4=4×25
由此可得基准分子的化学计量数:
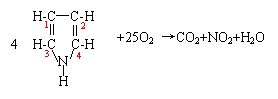
根据质量守恒,可观察配平产物的化学计量数。
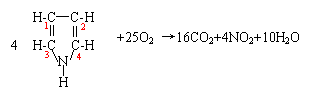
2.局部配平法
有机物的性质主要由官能团决定。很多化学反应发生在官能团上。其他部位的原子或原子团化合价没有变化,抓住局部官能团中原子的化合价变化,用化合价升降守恒法进行配平。
[例2] 硝基苯在酸性条件下被铁还原:
![]()
[分析]在此反应中,发生化合价改变的碳节为C—NO2,由于O为-2价,C与N共用一对电子,且偏向氮,所以其中碳为+1价,根据单碳节为零法,N元素的化合价为:(+1)+(—4)+N=0,N=+3价。同理,产物苯胺的C—NH2中,H为+1价,则N的化合价为—3价。
化合价升降关系为:
N:+3→—3,降低6
Fe:0→+2,升高2
降低6×1=升高2×3
由此配平氧化剂、还原剂、还原产物、氧化产物的化学计量数
![]()
最后观察配平HCl、H2O的化学计量数
![]()
[例3] 甲苯被酸性高锰酸钾氧化:
C6H5—CH3+KMnO4+H2SO4→C6H5—COOH+K2SO4+MnSO4+H2O
[分析] 该反应中有机物发生化合价改变的碳节是—CH3和—COOH,根据单碳节为零法和H为+1价,O为-2价,可知—CH3中C为—3价,—COOH中C为+3价。
化合价升降关系为:
C:—3→+3,升高6
Mn:+7→+2,降低5
降低5×6=升高6×5
由此配平氧化剂、还原剂、还原产物、氧化产物的化学计量数
5C6H5—CH3+6KMnO4+H2SO4→5C6H5—COOH+K2SO4+6MnSO4+H2O
最后观察配平H2SO4、K2SO4、H2O的化学计量数
5C6H5—CH3+6KMnO4+9H2SO4→5C6H5—COOH+3K2SO4+6MnSO4+14H2O
3.燃烧反应1-x法
首先确定有机物的化学计量数为1,O2为x,由质量守恒配定其它物质的化学计量数。最后确定x,代入整理得配平的化学方程式。
[例4] 乙苯的燃烧
C6H5-CH2CH3+O2→CO2+H2O
[分析] 首先确定乙苯的化学计量数为1,O2为x,由此,根据C、H元素质量守恒配平产物的化学计量数。
C6H5-CH2CH3+xO2→8CO2+5H2O
由氧元素质量守恒求得x:2x=2×8+5=21,x=21/2。将x值代入上式并整理得:
2C6H5-CH2CH3+21O2→16CO2+10H2O
[例5] 1—丁硫醇燃烧:
CH3-CH2-CH2CH2SH+O2→CO2+SO2+H2O
[分析] 由1—x可得如下配平式:
CH3-CH2-CH2-CH2SH+xO2→4CO2+SO2+5H2O
由氧元素质量守恒求得x:2x=2×4+2+5=15,x=15/2。将x值代入上式并整理得:
2CH3-CH2-CH2-CH2-SH+15O2→8CO2+2SO2+10H2O

- 全部评论(0)
