物质的量浓度 质量分数 密度类习题的解法
时间:2019-03-12 16:18 来源:未知 作者:贾珍贵 点击:次 所属专题: 物质的量浓度计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质的量浓度、质量分数、密度、体积大小类习题在高考题中出现的频率很高,这类题主要考查学生对基本概念的理解和公式的运算能力及其意义的理解。本文采用一题多变,引出同类习题的解题思路。
[例] 若以ω1和ω2分别表示浓度为c1mol/L和c2mol/L氨水的质量分数,且知2 c1= c2,则下列推断正确的是(氨水的密度比纯水小)
A.2 ω1= ω2 B.2 ω2=ω1 C.ω2>2 ω1 D.ω1> ω2> 2ω1
[分析] 依题意c2> c1,设ρ1和ρ2分别表示浓度为c1mol/L和c2mol/L氨水的密度,根据物质的量浓度与密度、溶质的质量分数的换算公式,有

当2 c1= c2时,2ρ1ω1= ρ2ω2
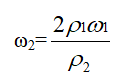
由于氨水的密度比水小,所以,氨水越浓,密度越小,即ρ1>ρ2 故ω2>2ω1
一般规律1:对于密度小于1的水溶液,当浓溶液的物质的量浓度等于稀溶液的两倍时,浓溶液的质量分数比稀溶液的质量分数的两倍要大。
说明:此题根据密度比水大的溶液,溶液越浓,密度越大。常见的有硝酸、硫酸、盐酸、及盐溶液。密度比水小的溶液,溶液越浓,密度越小。常见的有乙醇、氨的水溶液。运用公式分析变换,找出等量或不等式关系,得出结果。
[变化1] 若以ω1和ω2分别表示浓度为c1mol/L和c2mol/L氨水的质量分数,且知2ω1= ω2,则可推断出浓溶液的物质的量浓度与稀溶液的物质的量浓度大小的一般规律是
[分析] 根据
当2ω1= ω2时,
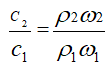
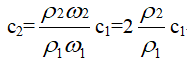
由于氨水的密度比水小,所以,氨水越浓,密度越小,即ρ1>ρ2故c2<2c1
一般规律2:对于密度小于1的水溶液,当浓溶液的质量分数等于稀溶液的质量分数两倍时,浓溶液的物质的量浓度比稀溶液的物质的量浓度的两倍要小。
[变化2] 若以ω1和ω2分别表示浓度为c1mol/L和c2mol/L硫酸的质量分数,且知2 c1= c2,则下列推断正确的是(氨水的密度比纯水小)
A.2 ω1= ω2 B.2 ω2=ω1 C.ω2>2 ω1 D.ω1> ω2> 2ω1
[分析] 根据例题的分析结果
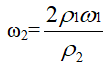
由于硫酸密度比水大,溶液越浓,密度越大,ρ1<ρ2 故ω2<2ω1
一般规律3:对于密度大于1的水溶液,当浓溶液的物质的量浓度等于稀溶液的两倍时,浓溶液的质量分数比稀溶液的质量分数的两倍要小
[变化3]若以ω1和ω2分别表示浓度为c1mol/L和c2mol/L硫酸的质量分数,且知2ω1= ω2,则可推断出浓溶液的物质的量浓度与稀溶液的物质的量浓度大小的一般规律是
[分析]根据变化1的结果

由于硫酸的密度比水大,所以,硫酸越浓,密度越大,即ρ1<ρ2 故c2>2c1
一般规律4:对于密度大于1的水溶液,当浓溶液的质量分数等于稀溶液的质量分数两倍时,浓溶液的物质的量浓度比稀溶液的物质的量浓度的两倍要大。

- 全部评论(0)
