化学电极判断分析
时间:2021-12-21 11:49 来源:未知 作者:田兴虎 点击: 次 所属专题: 电极判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有学生问:正(+)极是不是阳极,负(-)极是不是阴极;-、+与阴、阳是否都对应;一会儿负极发生氧化反应,正极发生还原反应,一会儿又是阴(-)极发生还原反应,这是怎么回事?有人认为,“阴极发生还原反应,阳极发生氧化反应”的说法是决不会有错,这又是怎么回事?就我所知,上述问题清楚的同学较少,处于混沌状态者比比皆是.值得注意的是,正(+)、负(-)、阴、阳的名称、符号,既是重要化学概念,也是学生学习、练习、考试试题中的关键词,应该搞清楚.
一、原电池中的“+、-”和“阴、阳”
1.原电池的结构以Cu-Zn原电池为例:
将Zn和锌盐溶液,Cu和铜盐溶液分置为两个半电池.两个半电池的外电路用导线、电流计接通,内电路用装有KCl饱和溶液(浸入棉花中)的U形管(盐桥)沟通.
2.Cu-Zn原电池的电极反应
在Zn半电池中,Zn失去电子变成Zn2+进入溶液,发生氧化反应:
Zn极Zn-2e→Zn2+(氧化反应)
在Cu半电池中,由Zn极出来的电子经外电路到Cu电极,溶液中的Cu2+得电子发生还原反应,析出金属铜:
Cu极Cu2++2e→Cu↓(还原反应)
3.原电池电极的+、-和阴、阳
对于化学电源电池的名称和符号,历来有两种习惯标准:
第一,按电子运动的方向把电子流出发生氧化反应的一极(如Zn)称负极(符号是“-”),而把电子流入发生还原反应的一极(如Cu)叫正极(符号是“+”).
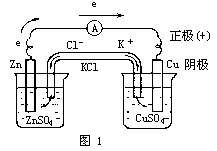
第二,按离子运动的方向当反应发生以后,Zn半电池溶液中,由于Zn2+增加,正电荷过剩;Cu半电池溶液中,由于Cu2+减少,负电荷过剩.为了保持两个半电池的电荷平衡,盐桥中的离子分别定向移动.按盐桥中阴、阳离子运动的方向规定:阴离子(Cl-)移向的极(Zn)叫做阳极,阳离子(K+)移向的极(Cu)叫做阴极.
我们把以上两种电极名称、符号汇集在Cu-Zn原电池上(如图1).
可见,在原电池里正极不是阳极,负极不是阴极,-、+与阴、阳并不对应.
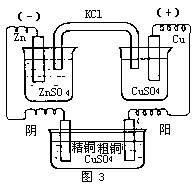
二、电解池的正(+)、负(-)和阴、阳
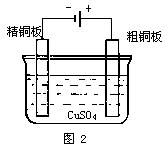
1.电解槽的结构和反应原理
图2是精炼铜的电解槽.直流电源的负极跟电解槽的精铜板相联,正极跟电解槽的粗铜板相联,CuSO4溶液是导电液.
电解是在外电流作用下被迫发生的氧化还原反应,把电能转变成化学能.而在原电池中正好相反,是自发的把化学能转变成电能.
2.电解槽电极+、-与阴、阳
确定电解槽电极的+、-与阴、阳的原则和方法跟原电池是相同的.
第一,按电子运动的方向电源的负极把电子输送给电解槽,这时我们把电解池跟电源负极相联的电极称为负(-)极(如精铜板),和电源正极(电势高,从那里抽走电子)相联的电极称为正(+)极.
第二,按离子运动的方向,当电源和电解槽的两极接通时,在电场的作用下,正(阳)离子向负极迁移,这时的负极(精铜板)称为阴极;负(阴)离子向正极迁移,这时的正极(粗铜板)称为阳极.
可见,在电解池里,负(-)极即阴极,正(+)极即阳极,-、+与阴、阳是对应的.
三、注意三个问题
1.习惯上原电池的电极常称正(+)、负(-);电解池的电极常称阴、阳.
2.为了书写方便和醒目起见,在文字叙述中用正、负,图示表示时用+、-.
3.无论是原电池还是电解池所发生的反应都是氧化还原反应.从电极的角度来看,阴极发生还原反应,阳极发生氧化反应;从反应的角度来看,发生还原反应的是阴极,发生氧化反应的是阳极.

- 全部评论(0)
