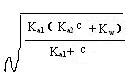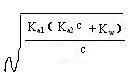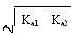一、比较[H+]与[OH-]的大小
在NaHCO3溶液中存在如下平衡:
H2O电离:H2O H++OH- Kw=1.0×10-14
H++OH- Kw=1.0×10-14
HCO3-的电离:HCO3- H++CO32- Ka2=5.6×10-11
H++CO32- Ka2=5.6×10-11
HCO3-的水解:HCO3-+H2O
 H2CO3+OH- Kh==Kw/Ka1=2.4×10-8
H2CO3+OH- Kh==Kw/Ka1=2.4×10-8
由于水解平衡常数Kh大于电离平衡常数Ka2,所以[OH-]>[H+]
二、比较[CO32-]与[OH-]的大小
在250C时,H2CO3(H2O+CO2)溶液中:
H2CO3 H++HCO3- Ka1= [H+][ HCO3-]/
[H2CO3]=4.2×10-7 ①
H++HCO3- Ka1= [H+][ HCO3-]/
[H2CO3]=4.2×10-7 ①
HCO3- H++CO32- Ka2=[H+][ CO32-]/ [
HCO3-]
=5.6×10-11 ②
H++CO32- Ka2=[H+][ CO32-]/ [
HCO3-]
=5.6×10-11 ②
在NaHCO3溶液中存在着如下两个平衡关系:
物料平衡:c=[Na+]=[HCO3-]+[CO32-]+[H2CO3]
电荷平衡:[Na+]+[H+]=[
HCO3-]+2[
CO32-]+[
OH-]
以上两式相减得:
[H+] +[H2CO3] = [
CO32-]+ [ OH-] ③
由①式得:[H2CO3] =[H+][
HCO3-]/ Ka1
由②式得:[ CO32-]==Ka2[
HCO3-]/ [H+]
由水的离子积常数Kw= [H+][
OH-],得:[ OH-]= Kw/[H+]
将以上三式代入③式,得:
[H+]+[H+][ HCO3-]/
Ka1= Ka2[ HCO3-]/
[H+]+ Kw/[H+]
[H+]=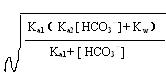 ④
④
一般情况下, HCO3-的电离和水解倾向都很小,溶液中的
HCO3-消耗很少,④式中的
HCO3-平衡浓度近似等于初始浓度c,即[
HCO3-]≈c。
故[H+]=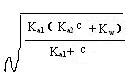 ⑤
⑤
当Ka2c>20Kw时,⑤中的Kw可忽略,得:
[H+]= 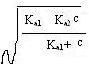 ⑥
⑥
当c>20
Ka1时,⑤中的
Ka1+c≈c,得:
[H+]= 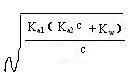 ⑦
⑦
当Ka2c>20Kw和c>20 Ka1时,⑥⑦均可进一步化简,得:
[H+]= 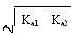 ⑧
⑧
利用上式可以计算出NaHCO3溶液中的 [H+],进而求出:[
CO32-]和[
OH-]。
由公式[
OH-]=Kw/[H+]和
[CO32-]==Ka2[
HCO3-]/
[H+]可知,Kw=Ka2[
HCO3-]时,[
CO32-]=[ OH-]。即[
HCO3-]=Kw/Ka2=1.0×10-14/5.6×10-11==1.8×10-4(mol/L)
结论:当[
HCO3-]>1.8×10-4(mol/L)时, [
CO32-]> [ OH-]>[
[H+]
当[
HCO3-]<1.8×10-4(mol/L)时, [ OH-]>[
CO32-]>[H+]
![]() H++CO32-
H++CO32- ![]() H2CO3+OH-
H2CO3+OH- ![]() H++HCO3-
H++HCO3- ![]() H++CO32-
H++CO32-