变化多端的铜阳极
时间:2021-12-21 14:06 来源: 作者:吴文中 点击: 次 所属专题: 电解氯化铜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【基本资料】
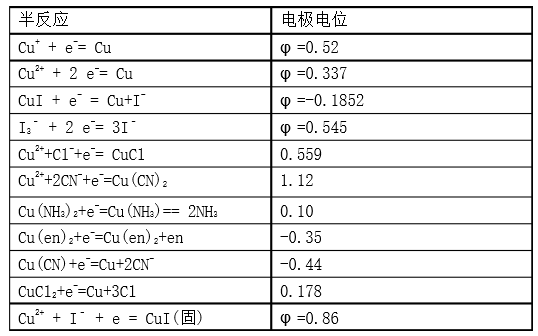
【经典例题1】
铜作电极,电解硫酸溶液
一开始:阳极:Cu -2 e-= Cu2+,阳极附近变蓝,阴极:产生氢气
一段时间以后:阳极:Cu -2 e-= Cu2+,阴极:产生氢气的同时,得到金属铜,最后无气体产生。
这是最常见的铜作电极的情况。
依据:Cu++ e-= Cu,
可以看出,在酸性条件下或中性条件下,金属铜作阳极时,铜一般是得到铜离子。
用铜电极电解饱和食盐水时
两极发生的电极反应分别为:
阳极:2Cu-2e-+2Cl-=2CuCl(氧化反应)
阴极:2H2O+2e-=2OH‑+H2(还原反应)
依据:Cu2++ 2 e-= Cu,
(3)通电一段时间后烧杯半透膜的左侧溶液出现蓝色后又消失,用文字解释消失的原因是 (反应后氯化钠溶液体积为100mL。已知lg2=0.3)
这可能和铜的核外电子排布有关,因为铜的基态电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1,因此,铜失去一个电子是“合法”的。
但是,我们常见的铜的离子,却主要是铜离子而不是亚铜离子,这主要可能是水溶液造成的,因为Cu+离子在酸性条件下,很容易歧化得到Cu2+和Cu。
这也是醛和新制的Cu(OH)2反应需要在碱性条件下进行的一个重要原因。
【经典例题4】
1.电解饱和的氯化铜溶液(都是石墨作电极),最后的产物却不是金属铜
2.CuCl的溶度积:Ksp(CuCl)=1.2×10-6
3.计算Cu2++ Cl-+ e-= CuCl(固)的电极电位
假c(Cl-) = 1.0 mol·L-1时,
E(Cu2+/CuCl)=E(Cu2+/Cu+)+0.0592lgC(Cu+)=Eq (Cu2+/Cu+)+0.0592lg{1/Ksp(CuCl)}= 0.158+0.0592lg(1/1.2×10-6)= 0.518 V
则Cu2++ Cl-+ e- = CuCl(固)电极电位为0.518,和以上数据(0.559)有差异,即和实验数据有差异,但无显著差异,说明计算合理。
显然c(Cl-)越大,则Cu2++ Cl-+ e-= CuCl(固)电极电位越大
【分析】
1.标准电极电位越大的离子氧化性越强,得电子的能力越强。
2.显然,比较上述有关数据表明,Cu2++ Cl-+ e- = CuCl最容易发生,其次是Cu2++ 2e-= Cu。
3.由于存在[(CuH2O)4]2++4Cl-==[CuCl4]2-的平衡,使得溶液中c(Cl-)减少,则Cu2++ Cl-+ e-= CuCl(固)电极电位会变小,则得到的CuCl的“机会”将减少。
4.但无任怎样只要CuCl2溶液的浓度越大,则得到CuCl会越多。
【结论】
1.对电解浓氯化铜溶液时,阴极出现“黑色”现象的原因做了初步的探究,得出其“黑色”并非是由微小铜粒产生的,而是生成的Cu+与溶液中的Cu2+和Cl-形成的配合离子或某些二聚物,使得溶液可能会变成“酱油色”、“棕黄色”、“黑色”的情况。
2.因此,电解氯化铜为了得到金属铜和氯气,则必须使用浓度较低的氯化铜溶液,如1mol/L 以下的溶液,甚至更低效果反而更好。

- 全部评论(0)
