原电池负极上的副反应探析
时间:2017-04-26 09:30 来源:未知 作者:赵胜 点击:次 所属专题: 原电池工作原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在原电池中,理论上,是在负极上发生氧化反应,在正极上发生还原反应,电子由负极通过外电路流向正极。但是,实际进行原电池的实验时,往往有副反应发生,即负极上也发生还原反应。以Cu - Zn 原电池为例,如图1 装置,理论上的反应是:
负极(Zn) : Zn-2e-=Zn2+(氧化反应)
正极(Cu) : 2H++ 2e-=H2↑(还原反应)
其现象应该是,在正极上有气泡产生,而负极逐渐消耗,没有气泡出现。但是,实际上,正极和负极上通常都有气泡产生,即负极上也有氢离子得电子的副反应发生。由于副反应的存在,原电池的效率就大大降低了。
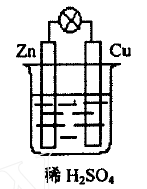
图1
对于这个现象,通常的解释是:作为负极材料的锌不纯,在锌片上形成了许多微小的原电池,所以锌片上有氢气生成。
为了探索原电池负极上发生副反应的原因,笔者进行了一系列实验,认为上述解释还有待于完善,现提出来与各位同行共同探讨。
1锌片纯度的影响
分别用分析纯的纯锌、不纯的锌(含杂质铅、碳等) 作负极,纯铜作正极,按图1 所示装置进行实验,结果如下:
用纯锌作负极的原电池,锌片上有少量气泡产生。用不纯锌作负极的原电池,锌片上有较多气泡产生。由此可见,锌片不纯,在锌片上自身就形成了许多微小的原电池,的确是锌片上发生副反应的原因。但是我们也看到,即使是用纯锌作原电池的负极,负极上还是有气泡,从而说明了锌片不纯不是原电池负极上发生副反应的唯一原因。
2外电路电阻的影响
原电池反应的实质是,在负极上某种微粒失去电子,电子由负极通过外电路流向正极,在正极上某种微粒得电子。这样,一个氧化还原反应就在2 个不同的位置(负极和正极) 进行。即在负极上进行氧化反应,在正极上进行还原反应,在外电路中产生了电流,化学能转变成了电能。
由以上分析可知,如果原电池的外电路存在电阻,电子的流动就受到阻碍,即,电子不容易由负极流动到正极,这样,溶液中的微粒要在正极上得电子就有一定难度,于是,有些微粒就会直接在负极上得电子。如上述Cu - Zn 原电池中,氢离子就可以从负极锌片上直接夺取电子生成氢气和Zn2+。下述实验可以证实这种分析。
在Cu - Zn 原电池中,在外电路连接一个可变电阻,如图2 ,首先,将滑动臂拨到最左端,此时外电路电阻很小,结果,我们看到,锌片上只有很少的气泡产生,铜片上产生大量气泡。然后,将可变电阻的滑动臂向右拨动,以增大外电路的电阻。这时我们可以明显看到,随着外电路电阻的增大,锌片上气泡产生的速率也增加,铜片上的气泡逐渐减少。如果断开外电路(即外电路电阻为无穷大) ,则可看到,铜片上不再有气泡出现,而只有锌片上产生很多气泡。
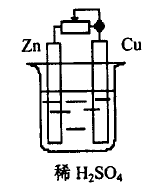
图2
通过以上分析和实验可知,原电池负极上发生的副反应,与外电路存在电阻有关,电阻越小,副反应越少,电阻越大,副反应越明显。
3电极极化作用的影响
将纯锌片与铜片用导线连接起来,或者将锌片和铜片直接焊接在一起,这样,锌片与铜片间的电阻很小,可以忽略不计,然后,将它们浸到稀H2SO4中形成原电池,如图3 、图4 。结果,开始时,锌片上没有气泡产生,但是,不久后,锌片上也慢慢有少量的气泡生成。这时因为,开始反应后,铜片上产生气泡,这些气泡先附在铜片上,当反应持续进行,气泡逐渐变大后,才离开铜片上升。这样,铜片上始终有很多微小气泡覆盖,影响了氢离子在铜片上得电子,锌片上的电子也就不能顺畅地输送到铜片上,所以,也有些氢离子在锌片上直接夺取电子生成氢气。这就是电极的极化作用。
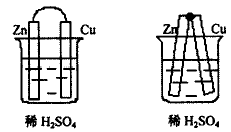
图3 图4
在这个实验中,如果将铜片上的气泡不断除去,例如将铜片不断震动,则锌片上就几乎看不到有气泡了。或者将装置改为图5 所示,使锌片不与稀H2SO4接触,这样,即使铜片上附有气泡,也不会有氢离子在锌片上得电子了,这就避免了因电极极化而发生的副反应。同时,这个装置也解决了外电路电阻引起的副反应问题,因为,无论外电路的电阻有多大,由于锌与ZnSO4溶液不反应,也就不会有微粒在锌片上得电子。
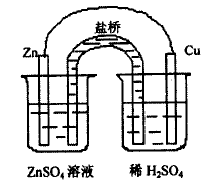
图5
以上分析了原电池负极上发生副反应的主要原因,另外,溶液中离子的迁移速率、溶液温度、负极材料的活泼性、溶液中电解质的性质等因素,也有影响。总之,正确、全面认识这些因素,对我们研究、提高化学电池的效率,增强用电化学方法防止金属腐蚀的效果,都有积极的意义。

- 全部评论(0)
