相对原子质量与质量数
时间:2016-03-22 23:09 来源:未知 作者:彭琳 点击:次 所属专题: 质量数 原子量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
教学中我们发现,相对原子质量与质量数概念较抽象。加之与其他量之间的关系较复杂,给教与学造成了较大困难。针对常见的认识上的偏差,我们将有关知识作如下剖析,帮助大家更深入理解相对原子质量与质量数。
一、元素、核素与质量数
元素指具有相同质子数(即核电荷数)的同一类原子的总称,是一个抽象概念。核素指具有一定数目的质子和一定数目中子的一种原子。同种元素的不同原子就是该元素的不同核素,它们互为同位素。质量数为原子核内质子数(Z)与中子数(N)的加和。我们不能说某元素的质量数是多少,只能说某核素的质量数是多少。
二、相对原子质量
1.相对原子质量的定义
国际原子量委员会1979年给原子量(即现在的相对原子质量)下的定义是“一种元素的原子量是该元素1 mol质量对核素12C 1 mol质量1/12的比值”。因为任何元素,其物质的量只要是1 mol,它所含的原子个数都相同(等于阿伏加德罗常数)。所以上述定义又可表述成“一种元素的一个原子的平均质量对核素12C的一个原子质量的1/12的比值”称为该种元素的相对原子质量。理解此概念,还应明确以下几点:
①相对原子质量是对电子与核处于基态的原子而言的;
②相对原子质量可对任何一个样品而言,样品中某元素因其组成不同,可以有不同的相对原子质量;
③国际原子量委员会发表的“标准相对原子质量表”是当时对地球上天然存在的元素所知其同位素丰度范围而言的;
④“一个原子的平均质量”(特定来源)为该元素的总质量除以原子总数。
2.相对原子质量的几种不同情况
同位素的发现使元素的相对原子质量概念复杂化了,可将其从以下几个方面区分:
①天然的单一核素元素的相对原子质量等于该核素一个原子的质量(u)对核素12C一个原子质量(u)的1/12的比值。原子质量单位(u),是一个12C原子质量的1/12。
目前已知元素中仅有9Be、18F、23Na、27Al、31P、55Mn、59Co、75As、89Y、93Nb、127I、133Cs、141Pr、165Ho和209Bi等15种元素未发现天然稳定同位素。
②多核素元素的相对原子质量是其天然同位素一个原子的平均质量对核素12C一个原子质量的1/12之比。即:
某元素的相对原子质量=某元素的平均原子质量(u)12u×1/12
这里的“一个原子的平均质量”是针对多核素元素而言的,可由互为同位素的各核素的原子质量和丰度来计算。具体关系是:
元素的平均原子质量(u)= ∑该元素的天然核素的原子质量(u)×丰度
应注意:丰度指在自然界中各核素原子的百分组成,并非质量百分组成。质量数在数值上与核素的原子质量很接近,因而也常用元素的各核素的质量数代替该核素的相对原子质量,用于计算元素的相对原子质量。但这样得到的相对原子质量一般叫元素的近似相对原子质量。
③人工放射性元素及某些天然放射性元素的相对原子质量是其半衰期最长的核素的质量数。
由此可见,只有为数很少的天然单一核素元素的相对原子质量等于该核素的相对原子质量。
目前,一些参考资料中有关相对原子质量与质量数的题目,时有命题不严谨现象。请看以下两例:
例1.元素天然核素A的一个原子中共有95个微粒,其中35个微粒不带电,则元素A的相对原子质量约为( )。
A.35 B.30 C.65 D.60
若不细究,很容易得出,该原子中有35个中子,质子数与电子数共95-35=60个,则质子数为30。质子数+中子数=30+35=65,约等于相对原子质量,选C。
但实际上,题目本身存在以下两个问题:
①质子数为30的Zn元素并无天然的质量数为65的核素,只有64Zn、66Zn、67Zn、68Zn、70Zn。
②元素Zn的相对原子质量是其所有天然核素的相对原子质量的平均值。即多核素元素的相对原子质量的近似值不是某核素的质量数。
例2.一个电子的质量约为一个质子(或中子)质量的1/1836,下面是部分原子的有关数据:
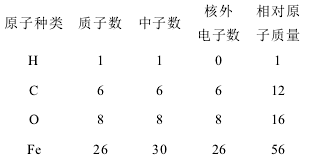
通过上列数据,可总结出“在原子里,质子数等于核外电子数”以外,还能得出什么结论?
因为初中教材中尚无核素的概念,元素相对原子质量的近似值除单核素元素外,不是某核素的质量数。而所列元素均不是单核素元素,此题有命题不严谨之嫌。
显然,这些题目中出现的问题都是因为对概念理解不深刻造成的。在今后的教学或命题中,我们都应倍加注意。

- 全部评论(0)
