物质结构说理题之原子结构问题
时间:2020-02-24 14:41 来源:未知 作者:化学自习室 点击:次 所属专题: 物质结构说理题 原子结构03
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、稳定性 H2S>H2Se 的原因是:
【答】H 键的键能比 Se-H 键的键能大。
2、焰色反应发生的原因为:
【答】激发态电子向基态跃迁,能量以光的形式释放(发射光谱)。
3、检验 K 元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:
【答】当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量。
4、NaBH4 的阴离子中一个 B 原子能形成 4 个共价键,而冰晶石(Na3AlF6)的阴离子中一个 Al 原子可以形成 6 个共价键,原因是:
【答】B 原子价电子层上没有 d 轨道,Al 原子价电子层上有 d 轨道。
5、Ge 与 C 是同族元素,C 原子之间可以形成双键、叁键,但 Ge 原子之间难以形成双键或叁键。从原子结构角度分析,原因是:
【答】Ge 原子半径大,原子间形成的σ单键较长,p−p 轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,不易形成双键或叁键。
6、碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试分析随着阳离子半径的增大,碳酸盐的分解温度逐步升高的原因:
【答】碳酸盐分解过程实际上是晶体中的金属阳离子结合 CO32- 中的氧离子,使 CO32- 分解为 CO2的过程, 所以当阳离子所带电荷数目相同时,阳离子半径越小,其结合氧离子的能力就越强,对应的碳酸盐就越容易分解 。
7、碳及其化合物广泛存在于自然界中,碳在形成化合物时,其键型以共价键为主,原因是:
【答】C 有 4 个价电子且半径较小,难以通过得或失电子达到稳定结构
8、Si、C 和 O 的成键情况如下:
化学键 | C—O | C=O | Si—O | Si=O |
键能(kJ·mol-1) | 360 | 803 | 464 | 640 |
C 和 O 之间易形成含有双键的 CO2 分子晶体,而 Si 和 O 之间则易形成含有单键的 SiO2 原子晶体,请结合数据分析其原因为:
【答】碳与氧之间形成含有双键的分子晶体放出的能量(803kJ·mol-1 ×2=1606kJ·mol-1)大于形成含单键的原子晶体放出的能量(360kJ·mol-1×4=1440kJ·mol-1),故CO2易形成含双键的分子晶体;硅与氧之间形成含有双键的分子晶体放出的能量(640kJ·mol-1 ×2=1280kJ·mol-1 )小于形成含单键的原子晶体放出的能量(464kJ·mol-1×4=1856kJ·mol-1),故SiO2易形成含单键的原子晶体。
9、Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne),原因是:
【答】Na+和 Ne 电子排布结构相同,而 Na+比 Ne 的核电荷数大,因此 Na+原子核对核外电子的吸引力大于Ne 原子核对核外电子的吸引力,所以 Na+更难失去电子,电离能更大。
10、一定条件下,CH4 和 CO2 都能与 H2O 形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4 与 H2O 形成的水合物俗称“可燃冰”。

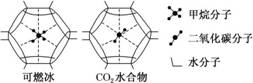
①“可燃冰”中分子间存在的2种作用力是 。
②为开采深海海底的“可燃冰”,有科学家提出用 CO2 置换 CH4 的设想。已知上图中笼状结构的空腔直径为 0. 586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是:
【答】①氢键、范德华力 ②CO2的分子直径小于笼状结构空腔直径,且与H2O 的结合能大于CH4
11、周期表前四周期的元素 a、b、c、d、e,原子序数依次增大。a 的核外电子总数与其周期数相同,b 的价电子层中未成对电子有 3 个,c 的最外层电子数为其内层电子数的 3 倍,d 与 c 同族;e 的最外层只有 1 个电子,但次外层有 18 个电子。回答下列问题;
(5)这 5 种元素形成的一种 1∶1 型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
(a)  (b)
(b)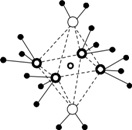
该化合物中,阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
![]()
12、硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:(5)碳和硅的有关化学键键能 如下所示,简要分析和解释下列有关事实:

![]() 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是:
![]() SiH4 的稳定性小于 CH4,更易生成氧化物,原因是:
SiH4 的稳定性小于 CH4,更易生成氧化物,原因是:
【答】①C—C 键和 C—H 键较强,所形成的烷烃稳定。而硅烷中 Si—Si 键和 Si—H 键的键能较低,易断裂。导致长链硅烷难以生成
②C—H 键的键能大于 C—O 键,C 一 H 键比 C—O 键稳定。而 Si—H 键的键能却远小于 Si—O 键,所以 Si—H 键不稳定而倾向于形成稳定性更强的 Si—O 键
13、已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是:
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是:

14、下表是两者的键能数据的:(单位:kJ/mol)
A-B | A=B | A≡B | |
CO | 351 | 745 | 1071.9 |
N2 | 139 | 418 | 946 |
结合数据说明 CO 比 N2 活泼的原因:
【答】CO 中第一个π键的键能是 326.9kJ/mol,N2 中第一个π键的键能是 528 kJ/mol,所以 CO 的第一个键比N2 更容易断裂,所以 CO 比 N2 活泼。
15、已知 NF3 与 NH3 的空间构型相同,但 NF3 不易与 Cu2+形成配离子,其原因是:
【答】N、F、H 三种元素的电负性为 F>N>H,在 NF3 中,共用电子对偏向 F,偏离 N 原子,使得氮原子上的孤电子对难于与 Cu2+形成配位键。
16、与H2O分子相比,OF2分子的极性更 (填“大”或“小”),原因是:
【答】小 都是V形分子,且孤电子对均为2,F与O的电负性差值小于H与O电负性差值,导致正负电荷中心偏离程度减小。
17、氮化铝晶胞结构如下,该晶体中存在配位键与共价键;判断晶体中有配位键的依据是:

【答】氮化铝晶体中,每个铝原子与 4 个氮原子结合,而铝原子只有 3 个价电子,需提供 1 个空轨道形成配位键以达到 8 电子对稳定结构。
18、(1)FeO熔点比Fe2O3熔点 (填“高”或“低”),原因:
(2)SO3 的三聚体环状结构如图,较短的键为 (填图1中字母),原因是:

(3)四氯化碳与水不互溶发生分层,四氯化硅与四氯化碳分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是:
(4)PBr5气态分子的结构与 PCl5相似,它的熔体也能导电,经测定知其中只存在一种 P﹣Br键长,试用电离方程式解释 PBr5熔体能导电的原因:
【答】(1)低 Fe2+半径比Fe3+大,电荷数小,FeO的晶格能较小
(2)b 形成 b键的氧原子与两个硫原子结合,作用力较小。
(3) 硅原子有3d空轨道,而碳原子没有d空轨道(因为没有2d),不能接受氧原子的孤对电子,所以四氯化硅能水解而四氯化碳不能水解。
(4) PBr5== PBr4 + + Br-
19、铵盐大多不稳定,NH4F、NH4I中,较易分解的是 ,原因是:
![]()
20、氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AlN | GaN |
熔点/℃ | 3000 | 22 00 | 1700 |
试从结构的角度分析它们熔点不同的原因:
![]()
21、铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行 实验,其中阴离子的空间构型是,该化合物加热时首先失去的组分是H2O,原因是:

22、H2SeO4 比 H2SeO3 酸性强的原因:
【答】H2SeO3 和 H2SeO4 可表示成(HO)2SeO 和(HO)2SeO2, H2SeO3 中的 Se 为+4 价,而 H2SeO4 中的 Se 为+6 价,正电性更高,导致 Se−O−H 中 O 的电子更向 Se 偏移,越易电离出 H+
23、NaBrO、 NaBrO2、NaBrO3、NaBrO4 四种钠盐中,Br 的杂化方式均为 sp3杂化,阴离子空间构型为三角锥形的是 NaBrO3 (填化学式)。上述四种钠盐对应的酸的酸性依次增强,试解释 HBrO4 的酸性强于HBrO3 的原因:
【答】HBrO3 和 HBrO4 可分别表示为(HO)BrO2 和(HO)BrO3,HBrO3中 Br 为+5 价而 HBrO4中 Br 为+7 价。后者正电性更高,导致 H、O 之间的电子对向 O 偏移,更易电离出 H+ 。
24、金属铜单独与氨水或单独与过氧化氢都不反应,但可与氨水和过氧化氢的混合溶液反应,其原因是:
【答】过氧化氢为氧化剂,氨与 Cu2+形成配离子,两者相互促进使反应进行。
25、已知硼酸(H3BO3)是一元酸,解释其原因:
【答】H3BO3 与一个水分子可形成配位键,产生[B(OH)4]- 和一个 H+ 。
26、H2SeO3 和 H2SeO4 第一步电离程度大于第二步电离的原因:
【答】第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子。

- 全部评论(0)
