路易斯结构式的书写
时间:2020-03-19 10:28 来源:未知 作者:庞晓峰 点击: 次 所属专题: 路易斯结构式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、路易斯理论的介绍
1916年,美国化学家路易斯通过对实验现象的归纳总结,提出分子中的原子之间可以通过共享电子对,使分子中的每个原子具有稳定的稀有气体电子结构(除了He为1P外,其他稀有气体的价电子构型均为ns2np6) ,这样形成的分子成为共价分子,原子之间通过共用电子对,形成的化学键称为共价键。路易斯提出了表示共价分子的方法,这些方法画出来的结构式统称为路易斯结构式。路易斯理论作为经典的共价键理论在化学键理论发展的历史长河中有着举足轻重的地位,因此成为中学化学竞赛的常考点。
二、路易斯结构式的书写
(一)8电子体系路易斯结构式的书写
下面以NO3-为例讲解路易斯结构式书写的一般步骤:
1.确定分子或者离子中原子的连接顺序
电负性小的原子由于其价电子被原子束缚的力较小,易于与其他原子成键,所以其周围排列的原子数通常比电负性大的原子多, 即通常做中心原子,即电负性小的原子通常放在中心,电负性大的原子放在端位,而像H或者X (卤素),由于其只需共用一对即可达到8电子,故自然放在端位。以NO3-为例它的原子连接顺序如图1所示

2.通过计算求出成键数和孤对电子对数
令n0为共价分子中所有原子为8电子构型(H为2电子构型)所需要的电子总数:
令nv为共价分子中所有原子的价电子数总和
令ns为共价分子中所有原子之间共用电子数总和
令nl为共价分子中所有原子的孤对电子数总和。
一个分子或者离子需要使得每个原子达到稀有气体结构,就必须通过共用电子对来实现,共用一对电子,对于整个分子或者离子而言可以理解成增加了2个电子,共用两对,对于整个分子或者离子而言可以理解成增加了4个电子,以此类推,很容易得出ns=n0-nv。 同时分子或者离子的nv可以理解为有两个去向,要么参与共用,要么成为孤对电子,所以不难得出nl=nv-ns。下面以NH3为例讲解n0、nv、ns,、nl的关系,对于NH3 而言n0=8+2×3=14, nv=5+1×3=8, ns=n0-nv=14-8=6, nl=nv-ns=8- 6=2。通过上述简单的计算可以发现NH3的Ns=6,成 键数=ns/2=3,孤对电子对数=nl/2=1。这和我们高中所学NH3的电子式完成吻合。图2是关于NO3-的计算结果。

3.路易斯结构式的书写
通过12两步,我们已经明确了NO3-中原子的连接方式以及里面的成键数为4,孤对电子对数为8,下面开始画出完整的路易斯结构式了,特别需要注意的是,路易斯结构式需要画出共振式,以硝酸根为例,事实上NO3-里面的NO键都是等价的,而非简单的一根 双键加两根单键,而共振式能很好地体现这一点。NO3-的路易斯结构共振式如图3所示。

电荷=5-4=+1, O原子的形式电荷有两种,单键O=6-1-6=-1,双键O=6-2-4=0,将计算结果表示在图上,一般微粒中各原子形式电荷 越少,该共振结构越稳定,对分子的贡献越大,NO3-结果如图4所示。

(二)特殊物质的路易斯结构式的书写
路易斯结构式会遇到一些特殊的情况,如缺电子体系、富电子体系,这也是路易斯理论解释不够完善的地方,但是后人也使用了 修正的方法,同样可以写出这些物质的路易斯结构式,修正方法如下:
对于缺电子或者富电子体系而言,对其中心原子所需的电子数不再认为是8个,而是修正为:中心原子的价电子数+所有配位原子成为8电子构型所需的电子数之和,
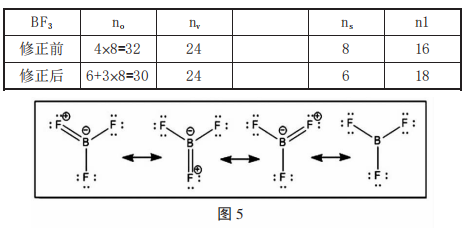
例如BeCl2的Be修正为 2+1×2=4, BF3的B 修正为3+1×3=6, PCl5的P 修正为5+1×5=10, SF6中的S 修正为6+1×6=12, XeF4中的Xe 修正为8+1×4=12, XeO4中 的Xe修正为8+2×4=16。修正以后计算n0时中心原子按照修正后的电子数带入计算,其他计算不变。下面以BF3、POCl3、PCl5为例讲 解这类特殊化合物的路易斯结构式书写。
例1.BF3按照计算结果可以画出以下结构如图5,其中前3个结构为修正前的,最后一个为修正后的。
例2.POCl3,按照计算结果可以画出以下结构如图6,其中第一个为修正前的,第二个为修正后的。

例3.PCl5按照计算结果可以画出以下结构如图7,按照修正前计算只成4根键,显然不合理,所以只能画出修正后的结构


- 全部评论(0)
(1675194379) 评论 href="/plus/view.php?aid=18397">路易斯结构式的书写:然而凭什么如此修正?求解答。 (NO2),5+2+2=9?
(22222222222) 评论 href="/plus/view.php?aid=18397">路易斯结构式的书写:化竞生表示感谢
(2977218496) 评论 href="/plus/view.php?aid=18397">路易斯结构式的书写:真的难。看不懂。不是大一下学期学嘛
