金属及其化合物超级判断汇总
时间:2020-04-07 11:17 来源:未知 作者:周学兴 点击:次 所属专题: 金属及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.烧碱、纯碱均属于碱,不能盛放在玻璃试剂瓶中
2.在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2
3.金属钠在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,产生黄色火焰
4.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火
5.钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑
6.实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶
7.钠在反应TiCl4+4Na Ti+4NaCl中作还原剂
Ti+4NaCl中作还原剂
8.用镊子从煤油中取出金属钠,切下绿豆粒大小的钠,小心放入装满水的烧杯中,观察钠 与水反应的现象
9.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,观察到火焰呈黄色,一定含有Na+, 可能含有K+
10.金属Na表面自然形成的氧化层不能保护内层金属不被空气氧化
11.钠与水反应:Na+2H2O=Na++2OH-+H2↑
12.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
13.9 g Na与足量氏0反应完全后可生成NA个氏分子
14.钠与 CuS04溶液反应:2Na+Cu2+=Cu+2Na+
15.1 mol Na2O2固体中含离子总数为4NA
16.7.8 g 过氧化钠含有的共用电子对数为0.2NA
17.Na2O2在与CO2的反应中既是氧化剂,又是还原剂
4.将足量过氧化钠投入紫色石蕊溶液中,溶液先变蓝色后褪色,同时有气泡产生
5 . Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物的原因是2Na2O2+2CO2===2Na2CO3+O2
32.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
33.过氧化钠能与水反应,所以过氧化钠可以作气体的干燥剂
34.过氧化钠与二氧化碳反应产生氧气,故可用于呼吸面具中
35.过氧化钠与二氧化碳反应时,过氧化钠只作氧化剂
36.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
37.Na2O2用于呼吸面具,活性炭用于防毒面具,两者原理相同
38.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
39.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具
40.二氧化碳使Na2O2固体变白,二氧化碳气体被还原
41.过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2NA
42.CO2通过Na2O2粉末后固体质量增重
31 .向CuSO4溶液中加入Na2O2的离子方程式为2Na2O2+2Cu2++2H2O=4Na++ 2Cu(OH)2 +O2↑
32.标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
33.用试管加热碳酸氢钠固体时,使试管口竖直向上
34.分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠出现,则说明两种物质均受热分 解
35.苏打是面包发酵粉的主要成分之一
36.NaHCO3溶液中加入稀盐酸:CO32-+2H+=CO2↑+H2O
37.用酚酞溶液可鉴别饱和食盐水与饱和纯碱溶液
38.小苏打能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但 不适合胃溃疡病人
39.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头
40.可以用澄清石灰水来鉴别Na2CO3溶液和NaHCO3溶液
41.往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀
42.NaHCO3受热易分解,可用于制胃酸中和剂
43.二氧化碳使Na2O2固体变白,二氧化碳气体被还原
44.碳酸氢钠药片是抗酸药,服用时喝些醋能提高药效。
45.钠在空气中燃烧可生成多种氧化物,9 g Na燃烧转移电子为1NA
46.将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡
47.用热的烧碱溶液洗去油污,是因为Na2CO3可直接与油污反应
48.碱金属元素随核电荷数递增,原子半径依次增大,还原性增强
49.从锂到铯都能够与水反应生成碱和H2
50.金属锂常用于制造锂电池,这跟它还原性强、密度小有关
51.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
52.所有金属及其化合物灼烧时火焰均有颜色
53.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
54.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
55.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
56.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
57.碳酸氢钠常用于治疗胃酸过多症
58.热的纯碱可去除油污
59.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
60.金属钠着火时,使用泡沫灭火器来灭火
61.NaOH应密封保存,以防分解变质
62.盛放KOH溶液的试剂瓶不能用磨口玻璃塞
63.当足量的CO2通入饱和NaOH溶液中,会有固体析出
64.受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2
65.等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多
66.常温下相同物质的量浓度的Na2CO3、NaHCO3溶液,前者碱性更强
67.向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀
68.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
69.熔融过氧化钠时不可使用石英坩埚
70.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
71.过氧化钠与二氧化硫反应时可生成硫酸钠
72.“侯氏制碱法”制取NaHCO3过程中,向饱和氯化钠溶液中先通入CO2,再通入NH3
73.氧化镁熔沸点高,可做耐火材料。
74.因氢氧化镁的溶解度小于碳酸镁,所以锅垢的成分为碳酸钙和氢氧化镁。
75.镁表面能形成氧化膜对内部金属起保护作用,因此实验室对镁条不需要特殊保护
76.镁失火可用CO2灭火器灭火
77.2.4 g Mg在足量中燃烧,转移的电子数为0.1NA
78.海水中提取镁所涉及的化学反应全都是氧化还原反应
79.将氯化镁晶体(MgCl2·6H2O)直接加热可制得无水氯化镁
80.有下列物质间转化:
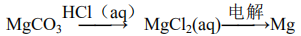
81.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性
82.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
83.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
84.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
85.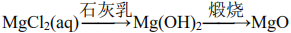
86.Mg(OH)2+2HCl===MgCl2+2H2O 可用离子方程式H+ + OH- ===H2O 表示
87.MgCl2溶液与氨水反应的离子方程式是:Mg2++2OH-===Mg(OH)2↓
88.电解氯化镁溶液可以制取金属镁
89.铝在自然界中有游离态和化合态两种形式
90.铝制餐具可长时间存放酸性或碱性食物
91.常温下,铝与稀硝酸反应可以制取氢气
92.铝在空气中耐腐蚀,所以铝是不活泼金属
93.冶炼铝时常用焦炭作还原剂
94.用NaOH溶液除去镁粉中的杂质铝2Al+2OH-+2H2O===2AlO2-+3H2↑
95.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下 来,说明铝的熔点较低
96.浓硝酸滴入用砂纸打磨过的铝条中,产生红棕色气体
97.给定条件下,下列转化能实现:
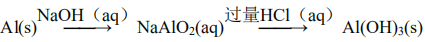
98.向1 mol·L-1AlCl3溶液中加过量的6 mol·L-1NaOH溶液制备Al(OH)3悬浊液
99.氢氧化铝具有弱碱性,可用于制胃酸中和剂
100.Al2O3熔点高,可用作耐高温材料
101.向Al2(SO4)3溶液中加入过量氨水的离子方程式:Al3++3NH3+H2O===Al(OH)3↓+3NH4+
102.氯化铝溶液滴入浓NaOH溶液中,产生大量白色沉淀
103.在水溶液中能大量共存:Na+、Al3+、Cl-、CO32-
104.硫酸铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O
105.偏铝酸钠溶液中通入过量 CO2:AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
106.Al(OH)3 溶于HCl 溶液中:Al(OH)3+3H+=Al3++3H2O
107.NaFe(SO4)2·6H2O可用于净水,作絮凝剂
108.Pb(CH3COO)2试纸用以检验H2S,产生黑色固体
109.KAl(SO4)2·12H2O可用于净水,作絮凝剂
110.镁-铝制品在空气中能稳定存在是因为铝不活泼
111.浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应
112..镁、铝均能与NaOH溶液反应
113.铝与Fe2O3发生铝热反应是利用了 Al的还原性比Fe强
114.氯化铝溶液和硫化钠溶液反应制备Al2S3
115.用镁粉和空气反应制备Mg3N2
116.用铝粉和MnO2制得锰
117.电解熔融氯化铝的方法制得单质铝
118.向氯化铝溶液中滴加过量氨水,最终得到澄清溶液
119.等质量的铝粉分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气
120.常温下铝与浓硝酸反应制得大量的NO2
121.AlCl3溶液加热蒸干得到无水氯化铝晶体
122.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗漆、干燥
123.用过量氨水除去Fe3+溶液中的少量Al3+
124.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
125.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
126.用铁制容器可以运输浓硝酸和浓硫酸
127.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
128.Fe在足量Cl2中燃烧生成FeCl2,在少量Cl2中燃烧生成FeCl3
129.根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性强弱
130.为较长时间看到Fe(OH)2白色沉淀可选用装置
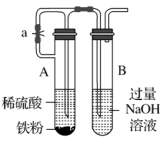
131.我国清代《本草纲目拾遗》中叙述了“铁线粉”:“粤中洋行有舶上铁丝,......日久起销,用刀刮其销,......,所刮下之销末,名铁线粉”。这里的“铁线粉”是指Fe2O3
132.将铁粉加入热的浓硫酸中:探究铁的活泼性
133.将热的NaOH溶液滴入FeCl3溶液中:制备Fe(OH)3胶体
134.在蒸发皿中加热蒸干FeSO4溶液:制备FeSO4·6H2O晶体
135.将铜粉加入FeCl3溶液中:验证Fe3+的氧化性强于Cu2+
136.FeCl3溶液与KSCN溶液反应的离子方程式为Fe3++3SCN-==Fe(SCN)3↓
137.可用铁粉除去FeCl2溶液中的FeCl3
138.将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红,检验Fe(NO3)2 晶体是否已氧化变质
139.室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色,说明 Fe3+的氧化性比I2的强
140.用NaOH溶液和盐酸能除去FeCl2溶液中混有的CuCl2
141.向混有Fe3+的Mg2+混合溶液中加入MgO或MgCO3或Mg(OH)2调pH,将Fe3+转化为 Fe(OH)3沉淀除去
142.用氯水、KSCN溶液检验FeCl3中是否有FeCl2
143.用酸性KMnO4溶液检验FeCl3中是否有FeCl2
144.用NaOH溶液检验MgCl2中是否有FeCl2
145.用硝酸检验某黄色固体是纯铜还是黄铜
146.绿矾(FeSO4·7H2O),可用作补血剂及植物的补铁剂。
147.高铁酸钾(K2FeO4),可用作水处理剂,可消毒和净水。
148.将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液呈红色, 稀硝酸将Fe 氧化为Fe3+
149.用可溶性的铝盐和铁盐处理水中的悬浮物
150.向FeSO4溶液中先滴入KSCN溶液,再滴加氏O2溶液,加入氏O2后溶液变成红色, Fe2+既有氧化性又有还原性
151.给定条件下,能实现转化:
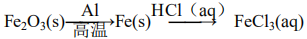
152.赤铁矿的主要成分是Fe3O4
153.铁与水蒸气在高温下的反应产物为Fe2O3和H2
154.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
155.Fe3-与KSCN产生血红色沉淀
156.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶 液,溶液显红色
157.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白 色的氢氧化亚铁
158.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管 中,滴加KSCN溶液2〜3滴,溶液显红色即可证明
159.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸 一会,然后冷却、过滤,滤纸上的物质为“蓝色固体”
160.1.0 mol·L-1的KNO3溶液:H+、Fe2.、Cl-、SO42-
161.酸性溶液中:NO3-、SO42-、Fe2+、Mg2+
162.向KI-淀粉溶液中加入FeC^溶液,溶液变蓝,说明Fe^能与淀粉发生显色反应
163.把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点,说明铁在潮湿的空气中易生 成Fe(OH)3
164.向稀硝酸中加入少量铁粉,有气泡产生,说明Fe置换出硝酸中的氢,生成了氢气
165.新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色,说明Fe(OH)2易被 氧化成Fe(OH)3
166.无水CuSO4只能作为检验水的试剂,经常作为水蒸气的吸收试剂而用于除杂。
167.CuO是黑色固体,与水反应生成Cu(OH)2
168.将气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
169.CuSO4·H2O失去结晶水属于物理变化
170.Cu2(OH)2CO3是铜锈的主要成分,在干燥的空气中铜不易生锈
171.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
172.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
173.向红色物质中加入稀硫酸,若溶液由无色变成蓝色,且有红色固体生成,则固体中含 有Cu2O。
174.将铜粉与硫粉混合均匀加热以制取CuS
175.向Cu与过量浓硫酸反应后的试管中加水以观察CuSO4溶液的颜色
176.向CuSO4溶液中加入过量的NaOH,过滤洗涤并收集沉淀充分灼烧以制取CuO
177.在淀粉溶液中加入适量稀H2SO4微热,再加少量新制Cu(OH)2悬浊液并加热,产生红 色沉淀
178.蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化,所以硫酸铜溶液可用作游泳 池的消毒剂
179.铜表面易形成致密的氧化膜,铜制容器可以盛放浓硫酸
180.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
181.合金中至少含有两种金属元素,不含非金属元素
182.合金中各种元素的含量一定,所以合金是纯净物
183.合金的硬度一般大于成分金属,而熔点一般低于成分金属
184.电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al
185.用金属钠置换四氯化钛(TiCl4)溶液中的钛来制取单质钛
186.将MgO与铝粉混合发生铝热反应制备镁
187.冶炼镁常用电解熔融MgO
188.湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应
189.加强热使CuO在高温条件下分解制备单质Cu
190.黑色金属材料包括铁、铬、锰及其化合物
191.生铁与钢的区别在于生铁含碳杂质,而钢不含
192.电解熔融氯化钠制取金属钠的反应中,Na+被还原
193.冶炼镁、铝采用电解法
194.用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol 电子
195.铝热法还原铁的反应中,放出的热量能使铁熔化
196.四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
197.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
198.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
199.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素
200.铁是人类在生产、生活中最早使用的金属材料
201.金、银、铜是应用最广泛的金属材料
202.钛被誉为“7世纪的金属”,应用前景很广阔
203.铜是导电性、导热性最好的有色金属
204.工业上通过电解氯化钠溶液制备金属钠和氯气
205.钢铁厂用热还原法冶炼铁
206.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
207.
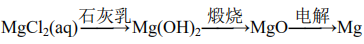
208.常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液变为蓝色
209.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
210.将CuCl2溶液在蒸发皿中加热蒸干,无法得到无水CuCl2固体
211.将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不损伤铜器
212.四种元素的单质都能和盐酸反应,生成相应的盐和氢气
213.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
214.将Mg棒和Al棒作为原电池的两个电极插入NaOH溶液中,Mg棒上发生氧化反应
215.铁锈的主要成分是氧化铁,铜锈的主要成分是氧化铜
216.硫酸铝蒸干后,可得到硫酸铝固体
217.可用稀盐酸除去铜器表面的铜绿
218.硫酸铜溶液可用作游泳池的消毒剂
219.CuCl2蒸干后得到CuO
220.FeCl3蒸干后得到Fe(OH)3,灼烧分解产生Fe2O3
221.工业上常采用电解法制取粗铜
222.SO2中的HCl,通常用饱和NaHSO3溶液吸收
223.根据化合价Fe3O4可表示为FeO+Fe2O3,则Fe3I8也可表示为FeI2+FeI3
224.铝罐可久盛食醋
225.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器中
226.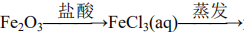 无水FeCl3物质间均能一步实现
无水FeCl3物质间均能一步实现
227.在FeCl3溶液中加入KHCO3溶液,会有CO2产生,但无Fe(OH)3沉淀生成
228.Fe和Fe2O3等物质的量混合物溶于稀盐酸时无气体放出
229.足量的Fe在Cl2中燃烧生成FeCl2和FeCl3
230.明矾作净水剂,可以除去废水中的铜离子
答案:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
错 | 对 | 对 | 错 | 对 | 对 | 对 | 错 | 对 | 对 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
错 | 对 | 错 | 错 | 错 | 错 | 对 | 对 | 错 | 错 |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
错 | 对 | 错 | 错 | 错 | 错 | 对 | 错 | 对 | 对 |
31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
对 | 错 | 错 | 错 | 错 | 错 | 对 | 对 | 对 | 错 |
41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
对 | 错 | 错 | 错 | 对 | 错 | 错 | 对 | 对 | 对 |
51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
错 | 错 | 错 | 对 | 错 | 错 | 对 | 对 | 对 | 错 |
61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
错 | 对 | 对 | 错 | 错 | 对 | 错 | 错 | 对 | 对 |
71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
对 | 错 | 对 | 对 | 对 | 错 | 错 | 错 | 错 | 错 |
81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
错 | 对 | 错 | 错 | 对 | 错 | 错 | 错 | 错 | 错 |
91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
错 | 错 | 错 | 对 | 错 | 错 | 错 | 错 | 对 | 对 |
101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 |
对 | 错 | 错 | 对 | 对 | 对 | 对 | 对 | 对 | 错 |
111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 |
错 | 错 | 对 | 错 | 错 | 对 | 错 | 错 | 对 | 错 |
121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 |
错 | 对 | 错 | 对 | 对 | 对 | 错 | 错 | 对 | 对 |
131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 |
对 | 错 | 错 | 错 | 对 | 错 | 对 | 错 | 对 | 错 |
141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 |
对 | 错 | 错 | 对 | 错 | 对 | 对 | 错 | 对 | 错 |
151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 |
错 | 错 | 错 | 对 | 错 | 错 | 错 | 对 | 错 | 错 |
161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 |
对 | 错 | 错 | 错 | 对 | 错 | 错 | 对 | 错 | 对 |
171 | 172 | 173 | 174 | 175 | 176 | 177 | 178 | 179 | 180 |
错 | 对 | 对 | 错 | 错 | 对 | 错 | 错 | 错 | 错 |
181 | 182 | 183 | 184 | 185 | 186 | 187 | 188 | 189 | 190 |
错 | 错 | 对 | 错 | 错 | 错 | 错 | 对 | 错 | 错 |
191 | 192 | 193 | 194 | 195 | 196 | 197 | 198 | 199 | 200 |
错 | 对 | 对 | 错 | 对 | 错 | 对 | 对 | 对 | 错 |
201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 |
错 | 对 | 错 | 错 | 对 | 错 | 错 | 错 | 错 | 对 |
211 | 212 | 213 | 214 | 215 | 216 | 217 | 218 | 219 | 220 |
错 | 错 | 对 | 错 | 错 | 对 | 对 | 对 | 对 | 对 |
221 | 222 | 223 | 224 | 225 | 226 | 227 | 228 | 229 | 230 |
错 | 对 | 错 | 错 | 对 | 错 | 错 | 对 | 错 | 错 |

- 全部评论(0)
