非金属及其化合物超级判断
时间:2020-04-15 22:30 来源:未知 作者:周学兴 点击:次 所属专题: 非金属及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.CO2与水反应生成碳酸,但 SiO2不溶于水,能用 SiO2与水反应制备硅酸。
2.SiO2既能与 HF 反应,又能与 NaOH 溶液反应,故 SiO2是两性氧化物。
3.12C、13C、14C 是碳的三种同素异形体
4.向空气中排放二氧化碳会形成酸雨
5.大气中二氧化碳的消耗途径主要是绿色植物的光合作用
6.向 Ca(ClO)2溶液中通入 CO2气体,溶液变浑浊,继续通入 CO2至过量,浑浊消失
7.晶体硅熔点高氢氟酸在玻璃器皿上刻蚀标记
8.硅是构成一些岩石和矿物质的基本元素
9.水泥、玻璃、水晶饰物都是硅酸盐制品
10.高纯度的硅单质是良好的半导体材料
11.陶瓷是人类应用很早的硅酸盐材料
12.水玻璃可用于生产黏合剂和防火剂
13.二氧化硅可用作光纤以及电脑芯片
14.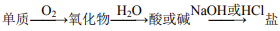 ,硅单质可以按上述关系进行转化
,硅单质可以按上述关系进行转化
15.若 A、B、C 分别为 Si、SiO2、H2SiO3,则可以通过一步反应实现如图所示的转化关系
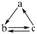
16.二氧化碳和二氧化硅都可溶解在 NaOH 溶液中
17.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式可表示为 Al2O3·SiO2·H2O
18.向饱和 Na2CO3溶液中通入足量 CO2,溶液变浑浊
19.向 Na2SiO3溶液通入 CO2,溶液变浑浊;继续通 CO2至过量,浑浊消失
20.向 Ca(ClO)2溶液加入品红溶液,红色褪去
21.向 Ca(OH)2溶液通入 CO2,溶液变浑浊;继续通 CO2至过量,浑浊消失;再加入足量 NaOH 溶液,又变浑浊
22.选用如图装置确认混合气体(CO、CO2)中含有 CO 气体
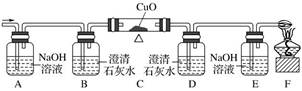
23.SO2通入 Na2SiO3溶液产生胶状沉淀,证明酸性 H2SO3>H2SiO3
24.SiO2硬度大,故可用于制造光导纤维
26.石英砂可用于生产单晶硅
27.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
28.Fe(OH)3胶体无色、透明,能产生丁达尔现象
29.H2、SO2、H2S、CO2三种气体都可用浓 H2SO4干燥
30.SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物
31.硅酸钠可用来制作黏合剂(矿物胶),耐火阻燃材料。
32.NaOH 溶液可以用玻璃瓶盛放,但不能用玻璃塞而使用橡胶塞。
33.玻璃是一种晶体,有较高的熔点
34.水玻璃是一种特殊的玻璃,泡花碱属于碱
35.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料
36.光导纤维、碳纳米管、氮化硅结构陶瓷等都是新型无机非金属材料
37.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
38.Al2O3、MgO 和 SiO2均具有很高的熔点,故可制耐火材料
39.钢化玻璃与普通玻璃的主要成分基本相同
40.制普通玻璃的原料是石灰石、纯碱和石英砂
41.陶瓷是人类应用很早的硅酸盐材料
42.水玻璃是纯净物,可用于生产黏合剂和防火剂
43.向含K+、Na+、Br-、SiO32-的溶液中通入CO2后仍能大量共存
44.合成纤维和光导纤维都是新型无机非金属材料
45.NaHCO3溶液中含有 Na2SiO3杂质,可通入少量 CO2后过滤
46.SiO2中含 Al2O3杂质,可加入足量稀盐酸溶液,然后过滤除去
47.压电陶瓷、Al2O3陶瓷、SiC 等属于新型无机非金属制品的是
48.展柜使用的钢化玻璃,其主要成分只有 SiO2
49.墙体使用的砖瓦、水泥,是硅酸盐材料
50.陈列的元青花瓷的原料有高岭土[Al2Si2O5(OH)4],也可以表示为 Al2O3·SiO2·H2O
51.展示的青铜器上有一层绿色物质可能是碱式碳酸铜,此绿色物质不溶于盐酸
52.两者结合形成的化合物是共价化合物
53.C、Si 在自然界中都能以游离态存在
54.C、Si 的氢化物的热稳定性比较:CH4<SiH4
55.C、Si 的最高价氧化物都能与水反应生成相应的酸
56.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
57.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂物质的量之比是 3∶4
58.现代海战通过喷放液体 SiCl4(极易水解)和液氨可产生烟幕,其主要成分是 NH4Cl
59.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),不涉及氧化还原反应
60.SiO2中含 Al2O3杂质,可以加入足量 NaOH 溶液然后过滤除去
61.CO2中含有 CO 杂质,可以通入盛有 CuO 的玻璃管且加热
62.CO2中含有 HCl 杂质,可以通过盛有 Na2CO3溶液的洗气瓶
63.Na2CO3溶液中含有 Na2SiO3杂质,可以通入足量的 CO2,然后过滤
64.沙子和黏土主要成分为硅酸盐
65.“凡坯既成,干燥之后,则堆积窑中燃薪举火”中“燃薪举火”使黏土发生复杂的物理化学变化
66.黏土是制作砖瓦和陶瓷等的主要原料
67.原硅酸钠(Na4SiO4)能迅速水解,且水解后呈碱性,故 Na4SiO4为弱电解质
68.石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品
69.2HCl+Na2SiO3===H2SiO3↓+2NaCl 说明 Cl 的非金属性强于 Si
70.半导体工业所说的“从沙滩到用户”是指将二氧化硅制成晶体硅
71.干燥的 Cl2没有漂白性,但 Cl2能使湿润的有色布条褪色
72.干燥漂白粉没有漂白性
73.化石燃料完全燃烧不会造成大气污染
74.起漂白作用的是 HClO
75.用 pH 试纸测量氯水的 pH。
76.HClO 不稳定,不能单独存在
77. “84”消毒液的主要成分为 NaClO,漂粉精的有效成分为 Ca(ClO)2
78.84消毒液和洁厕灵不能混合使用,其原因是ClO-+Cl-十2H+=Cl2+H2O。
79.过量的铁粉在少量氯气中加热,充分反应后产物为 FeCl2
80.标准状况下,11.2 L Cl2与水充分反应转移电子数为 0.5NA
81.Cl2能使湿润的淀粉碘化钾试纸变蓝,说明 Cl2具有氧化性
82.氯气作水的杀菌消毒剂时没有发生化学变化
83.新制取的漂白粉是混合物
84.氯气的酒精溶液能使干燥的蓝色石蕊试纸先变红后褪色
85.红热的铜丝在氯气里剧烈燃烧,产生棕黄色的烟
86.通常状况下,干燥的氯气能和 Fe 反应
87.纯净的 H2在 Cl2中安静地燃烧,发出苍白色火焰,集气瓶瓶口呈现雾状
88.氯气能与水反应生成 HClO 和 HCl,久置氯水最终变为稀盐酸c(H+)
89.在新制饱和氯水中再通入少量氯气,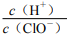 减小
减小
90.在新制饱和氯水中通入少量 SO2,溶液漂白性减弱
91.在新制饱和氯水中加入少量的碳酸钠粉末,pH 增大,溶液漂白性增强
92.在新制饱和氯水中光照过程中,有气泡冒出,溶液的导电性增强
93.向新制氯水中加入少量 NaHCO3、CaCO3、足量 Na2CO3固体,均能增强溶液漂白能力
94.NaClO溶液中,存在Ag+、K+、NO3-、CH3CHO
95.向该 NaClO 溶液中滴入少量 FeSO4溶液,反应的离子方程式为 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
96.光照 H2和 Cl2的混合气体时,因迅速化合而爆炸
97.已知:2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O,H2O2作氧化剂
98.已知:ClO2熔点-59 ℃、沸点 11 ℃可冰水浴收集 ClO2
99.H2O2作氧化剂,使用过程中往往需要过量,主要原因是其不稳定性,受热易分解,遇某些金属阳离子易催化分解
100.MnO2与稀盐酸反应制备氯气。
101.为了减少制得的 Cl2中 HCl 的含量,所以加热温度不宜过高,减少 HCl 的挥发。
102.实验结束后,先使反应停止并排出装置中残留的 Cl2,再拆卸装置,避免污染空气。
103.尾气吸收时,往往用澄清石灰水吸收 Cl2
104.酸化 KMnO4溶液,用的是 H2SO4酸化而不是盐酸
105.酸性高锰酸钾不能用能氧化亚硫酸盐,以测定硫元素含量
106.将 Cl2与 HCl 混合气体通过饱和食盐水可得到纯净的 Cl2
107.为了减少制得的 Cl2中 HCl 的含量,所以加热温度不宜过高,以减少 HCl 的挥发
108.除去 Cl2中少量 HCl 气体,可用饱和食盐水,也可用饱和碳酸氢钠溶液
109.过量浓盐酸与一定量的二氧化锰反应,MnO2能完全反应
110.检验氯气可用湿润的淀粉碘化钾试纸
111. 盛浓硫酸,干燥氯气
盛浓硫酸,干燥氯气
113.蒸干氯化锰溶液制 MnCl2·4H2O
114.氯碱工业的主要流程如下:
115.
116.海水提溴过程中,SO2吸收 Br2,起到了富集的作用。
117.海带置于坩埚中煅烧,并用玻璃棒搅拌
118.用 CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色
119.实验室保存少量液溴时常加少量水液封,并用玻璃塞密封,不能用橡胶塞
120.类比 Fe 与 Cl2反应,可知 Fe 与 I2反应产物为 FeI3
121.I 原子半径大于 Br,HI 比 HBr 热稳定性强
122.可以用淀粉溶液检验加碘食盐中的 KIO3
123.氯水分别滴入 KBr、NaI 溶液中颜色加深,而溴水滴入 NaCl 溶液中无明显变化,滴入KI-淀粉溶液中,溶液变蓝,故 Cl2>Br2>I2
124.H2和 Cl2的混合气体光照爆炸,H2和 Br2的混合气体加热才能反应,而 H2和 I2反应更困难,故 Cl2>Br2>I2
125.Fe 分别与 Cl2、Br2、I2反应生成 Fe 的化合物的化合价高低,故 Cl2>Br2>I2
126.HCl、HBr、HI 的热稳定性越来越差,故 Cl2>Br2>I2
127.将少量食用盐溶于白醋中,然后滴到淀粉-KI 试纸上,若试纸变蓝色,说明此食用盐为加碘食盐。
128.实验室用带玻璃塞的棕色瓶贮存液溴
129.电解饱和 MgCl2溶液时在阴极得到 Mg
130.加碘食盐可用淀粉溶液检验其中的碘
131.某溶液加入氯水后振荡,再加入 CCl4振荡,下层显示紫色,说明原溶液中一定含有 I-
132.某溶液中滴加 AgNO3溶液和稀硝酸,产生淡黄色沉淀,说明原溶液中一定含有 Br-
133.要除去 KBr 溶液中混有的单质 Br2,可用酒精萃取除去
134.可用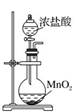 实验室制取氯气
实验室制取氯气
135.可用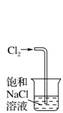 吸收尾气氯气
吸收尾气氯气
136.工业生产中常选用 NaOH 作为沉淀剂,沉淀 Mg2+
137.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2将其还原吸收
138.干燥的 Cl2和氯水均能使鲜花褪色
139.久置的氯水仍具有漂白性
140.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
141.无色溶液 C 加入 AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则 C 必含 Cl-
142.通过化合反应不能制得氯化亚铁
143.用 pH 试纸测得氯水的 pH=4
144.溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色
145.由 Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO 可推出 Ca(ClO)2+SO2+H2O===CaSO3↓+ 2HClO
146.溴单质可以和烧碱溶液反应
147.溴的单质只具有强的氧化性
148.溴与氢气在一定条件下反应能生成溴化氢
149.溴离子可以用硝酸酸化的 AgNO3溶液来检验
150.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
151.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
152.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
153.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
154.加入的有机溶剂是裂化汽油萃取溴水中 Br2
155.可用 Cl2和 NaClO2制备 ClO2,其中n(氧化剂)∶n(还原剂)=1∶2
156.ClO2在强碱性环境中使用失效:2ClO2+2OH-===ClO-3+ClO-2+H2O
157.ClO2处理饮用水时残留的 Cl2O-+2Fe2++4H+===2Fe3++Cl-+2H2O
158.等物质的量的 ClO2杀菌效果比 Cl2、HClO 强
159.可用盛浓硫酸干燥剂干燥气体
160.单质硫燃烧与氧气反应时,产物是 SO2,过量 O2生成 SO3。
161.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(Hg+S===HgS)。
162.实验室中,残留在试管内壁上的硫可用 CS2溶解除去,也可用热的 NaOH 溶液除去。
163.SO2能漂白酸、碱指示剂,使紫色石蕊试液先变红后褪色。
164.SO2能使溴水、酸性 KMnO4溶液褪色,体现了 SO2的还原性而不是漂白性。
165.SO3在标准状况下为固态。
166.SO3的沸点 44.8 ℃,加热制得 SO3的可用冰水浴冷凝收集。
167.三氧化硫在标况下是固体,在通常状况下是液体,但是二氧化硫氧化条件下生成的三氧化硫为气体。
168.硫与铁反应生成硫化亚铁
169.硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫
170.二氧化硫可广泛用于食品的漂白
171.二氧化硫作纸浆漂白剂的过程中没有发生化学变化
172.SO2有漂白性,所以 SO2可使溴水褪色
173.SO2通入硝酸钡溶液中,最终能产生白色沉淀是 BaSO3。
174.改燃煤为燃气,可以减少废气中 SO2等有害物质的排放量,是治理“雾霾”等灾害天气的一种措施
175.向煤中加入适量石灰石,使煤燃烧产生的 SO2最终生成 CaSO3,可减少对大气的污染
176.大量燃烧化石燃料排放的废气中含 SO2,从而使雨水的 pH<5.6 形成酸雨
177.硫和氮的氧化物是形成酸雨的主要物质
178.工业上常见的 SO2尾气处理方法有钙基固硫法最终产物为 CaSO4
179.可用 Na2CO3溶液来吸收 SO2尾气
180.反应 NaCl(固体)+H2SO4(浓) NaHSO4+HCl↑,利用浓 H2SO4的高沸点性可以制取HCl
NaHSO4+HCl↑,利用浓 H2SO4的高沸点性可以制取HCl
181.浓 H 2SO4稀释的方法是:将水沿器壁慢慢注入浓 H2SO4中并用玻璃棒不断搅拌。
182.少量胆矾加入浓硫酸中蓝色固体变白,体现了浓硫酸的脱水性
183.用玻璃棒蘸取浓硫酸滴在滤纸上,滤纸变黑,体现了浓硫酸的吸水性
184.将铜片加入盛有浓硫酸的试管中加热,铜片逐渐溶解,产生无色刺激性气味的气
185.为测定a g Na2SO3、Na2SO4混合物样品中 Na2SO3 的质量分数,可向样品中加足量 H2O2 溶液,再加足量 BaCl2 溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
186.常温下,铁、铝遇浓 H2SO4钝化,体现了浓硫酸的强氧化性
187.可用铝槽车运输浓 H2SO4
188.足量的纯净 Zn 与浓硫酸加热反应,产生的气体是 SO2
189.常温下,将铁片浸入足量浓硫酸中,铁片不溶解,说明常温下铁与浓硫酸一定没有发生化学反应
190.用 实现实验室制取 SO2
实现实验室制取 SO2
191.为测定a g Na2SO3、Na2SO4混合物样品中 Na2SO3的质量分数,可将样品与足量稀盐酸充分反应后,再加入足量 BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为d g
192.浓 H2SO4溅到皮肤上时立即用稀 NaOH 溶液冲洗
193.浓 H2SO4滴入蔗糖固体中,将产生的气体通入溴水,溴水褪色,说明浓硫酸具有脱水性、氧化性
194.用浓 H2SO4除去 HCl 中的 H2O(g)
195.在未知液中滴加 BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在SO32-或SO42-
196.蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应
197.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于酸
198.向 50 mL 18 mol·L-1的 H2SO4溶液中加入足量的铜片加热充分反应后,被还原的 H2SO4的物质的量等于 0.45 mol
199.常温下,浓 H2SO4可以用铝制容器贮存,说明铝与浓硫酸不反应
200.如图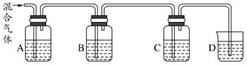 当 A、B、C、D 中分别盛有品红、NaOH 溶液、品红、澄清石灰水时,可用于 SO2和 CO2混合气体的检验
当 A、B、C、D 中分别盛有品红、NaOH 溶液、品红、澄清石灰水时,可用于 SO2和 CO2混合气体的检验
201.汽车尾气是导致酸雨的原因之一
202.酸雨会使土壤、湖泊酸化
203.酸雨形成中不涉及氧化还原反应
204.燃煤中加入生石灰可防治酸雨
205.为了检验铜单质与浓硫酸反应的产物中含有 CuSO4,待充分反应偶,直接向反应液中直接加入水稀释
206.金属 Mg 与稀硫酸、CO2均能反应,但其反应类型不同
207.浓硫酸与铜反应既体现了其强氧化性又体现了其酸性
208.铁在纯氧中燃烧或高温下和水蒸气反应均能得到 Fe3O4
209.SO2气体通入 Ba(NO3)2溶液中,有白色沉淀生成
210.浓 H2SO4有吸水性,可用于干燥氨气
211.为测定 a g Na2SO3、Na2SO4混合物样品中 Na2SO3的质量分数,可将样品配制成 V1L 溶液,取其中 25.00 mL 用标准 KMnO4溶液滴定,消耗标准 KMnO4溶液的体积是 V2mL
212.为测定a g Na2SO3、Na2SO4混合物样品中 Na2SO3的质量分数,可将样品与足量稀盐酸充分反应,生成的气体通过盛有碱石灰的干燥管,测得干燥管增重c g
213.可用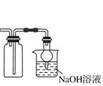 吸收尾气 SO2
吸收尾气 SO2
214.N2能直接被氧化为 NO2
215.Mg3N2只能干态制取,在水溶液中,能强烈与水反应,生成氢氧化镁沉淀,放出氨气
216.实验测得 NO2的平均相对分子质量总大于 46
217.NOx的处理。
219.用向上排空气法收集铜粉与稀硝酸反应产生的 NO
220.密闭容器中 2 mol NO 与 1 mol O2充分反应,产物的分子数为 2NA
221.燃料的脱硫脱氮、SO2的回收利用和 NOx的催化转化都是减少酸雨产生的措施
222.制取 NO2时,用水或 NaOH 溶液吸收尾气
223.通过灼热的镁粉,可除 N2中的少量氧气
224.NO2与水反应,NO2作还原剂,水作氧化剂
225.某溶液中含有大量的 NO3-,该溶液中一定不存在大量的Fe2+
226.闪电时,空气中的N2和可直接化合生成NO2
227.除去 NO 中混有少量 NO2气体时,可以用水洗涤后再干燥
228.市售浓硝酸呈黄色的原因是:硝酸分解生成的 NO2溶解在硝酸里
229.硝酸要保存在棕色试剂瓶中,置于冷暗处,能用橡胶塞。
230.常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶盛放。
231.浓硝酸在光照下久置,会变黄
232.将铁屑放入稀 HNO3中证明 Fe 比 H2活泼
233.向稀 HNO3中滴加 Na2SO3溶液:S3NH+,取少量试液于试管中,加入 NaOH 溶液并加热,用湿润的红色石蕊试纸检验产生的气体
247.加热盛有 NH4Cl 的试管,试管底部有固体消失,试管口有晶体凝结,说明 NH4Cl 固体可以升华
248.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
249.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
250.将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性
251.加热 NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明 NH4HCO3受热不稳定
252.将红热的 Pt 丝伸入盛有浓氨水的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为 NO2
253.N2H4的电子式为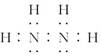
254.所有的铵盐都能与烧碱共热生成氨气
255.浓硝酸不论与铜反应还是与碳反应,均体现其酸性和强氧化性
256.一氧化氮结合血红蛋白的能力比一氧化碳还强,更容易造成人体缺氧
257.把带火星的木条伸入充满 NO2和 O2混合气体(NO2和 O2的物质的量之比为 4∶1)的集气瓶中,木条复燃,说明 NO2支持燃烧
258.海水淡化的方法有蒸馏法、电渗析法、离子交换法
259.1 mol 一元中强酸次磷酸(H3PO2)最多消耗 1 mol NaOH,产物呈酸性
260. 用作气体体积定量分析时,可消除分液漏斗液体进入圆底烧瓶对气体体积的影响
用作气体体积定量分析时,可消除分液漏斗液体进入圆底烧瓶对气体体积的影响
261.Al 在氧气中燃烧时发出耀眼的白光,可用于制造信号弹
262.铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸
263.明矾可用于除去酸性废水中的悬浮颗粒
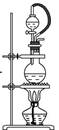
264.用高纯度的二氧化硅制作的光导纤维遇强碱会“断路”
265.炒菜时加一点酒和醋,有酯类物质生成,使菜味香可口
266.不能用 SiO2与水反应的方法来制取硅酸,不能用瓷坩埚来加热烧碱或纯碱使其熔化
267.硅胶可用作食品干燥剂
268.烧结黏土制陶瓷不涉及到化学变化
269.陶瓷、水晶、水泥、玻璃都属于硅酸盐
270.
271.
272.![]()
273.
274.Cl2——作消毒剂、AgBr——制胶卷,感光纸
275.AgI——人工降雨、淀粉——检验 I2的存在
276.NaClO——漂白纺织物
277. 除去氯气中的 HCl 气体
除去氯气中的 HCl 气体
278.用汽油作为提纯溴的萃取剂
279.利用 ,根据①浓硫酸,②蔗糖,③溴水,证明浓硫酸具有脱水性、氧化性
,根据①浓硫酸,②蔗糖,③溴水,证明浓硫酸具有脱水性、氧化性
280.利用 ,根据①稀盐酸,②Na2SO3,③Ba(NO3)2 溶液,证明 SO2 与可溶性钡盐均可生成白色沉淀
,根据①稀盐酸,②Na2SO3,③Ba(NO3)2 溶液,证明 SO2 与可溶性钡盐均可生成白色沉淀
281.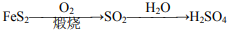 在给定条件下可实现上述转化
在给定条件下可实现上述转化
282.用 Na2S 作沉淀剂,除去废水中的 Cu2+和 Hg2+
283.自然界中不存在游离态的硫
284.NO 能够与人体里血红蛋白结合,造成人体缺氧中毒
285.在实验室里,NO 和 NO2均可用排水法收集
286.NO2通入 FeSO4溶液中始终无明显现象
287.所有铵盐受热均可以分解,但产物不一定有 NH3
288.加热可除去 NH4Cl 中的少量 NaHCO3
289.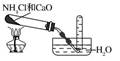 实验室制取氨
实验室制取氨
290.利用 ,根据②中酚酞 2 试液变红,能证实①中加热 NH4Cl 和 Ca(OH)2混合物发生反应生成 NH3
,根据②中酚酞 2 试液变红,能证实①中加热 NH4Cl 和 Ca(OH)2混合物发生反应生成 NH3
291.用湿润的碘化钾淀粉试纸鉴别 Br2(g)和 NO2
292.ClO2具有强氧化性,ClO2可用于自来水的杀菌消毒
293.植物纤维可用作食品干燥剂
294.甘氨酸(H2N—CH2—COOH)既有酸性,又有碱性,是最简单的氨基酸
295.α-氨基丙酸与 α-氨基苯丙酸混合物脱水成肽,只生成 2 种二肽
296.用水鉴别苯、乙醇、溴苯
297.用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳
298.用石蕊试液鉴别酒精、醋酸、醋酸钠
299.淀粉、油脂和蛋白质都是高分子化合物
300.乙烯和乙醇均可使酸性 KMnO4溶液褪色
301.乙酸乙酯和植物油均可水解生成乙醇
302.包装用材料聚乙烯和聚氯乙烯都属于烃
303.合成纤维和光导纤维都是新型无机非金属材料
304.误食重金属盐引起人体中毒,可喝大量的食盐水解毒
305.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
306.将铁屑放入稀 HNO3中证明 Fe 比 H2活泼
307.液氨汽化时要吸收大量的热,可用作制冷剂
308.食品袋中充氮气可用来防腐
309.富含硫黄的矿物在工业上可用于制造硫酸
310.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
311.用硫酸清洗锅炉中的水垢
312.用 SO2漂白纸浆和草帽辫
313.碳与浓硫酸共热,只表现浓硫酸的强氧化性
314.卤素的钾盐中,最易被氧化的是氟化钾
315.碘易升华,盛放在有水的棕色广口试剂瓶中
316.液溴易挥发,盛放在用水液封的棕色试剂瓶中
317.氯水、氯气、液氯均能与硝酸银溶液反应产生白色沉淀
318.某溶液加入 CCl4,CCl4层显紫色,证明原溶液中存在 I-
319.新制氯水中含有 H2O、Cl2、HClO、HCl 等多种分子
320.新制氯水长期放置后溶液的酸性减弱
321.二氧化碳、二氧化硅的物理性质相似
答案:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
错 | 错 | 错 | 错 | 对 | 对 | 错 | 对 | 错 | 对 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
对 | 对 | 错 | 错 | 错 | 对 | 错 | 对 | 错 | 对 |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
对 | 对 | 对 | 错 | 对 | 对 | 错 | 错 | 错 | 错 |
31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
对 | 对 | 错 | 错 | 对 | 对 | 错 | 对 | 对 | 对 |
41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
对 | 错 | 错 | 错 | 错 | 对 | 对 | 错 | 对 | 错 |
51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
错 | 错 | 错 | 错 | 错 | 错 | 错 | 对 | 错 | 错 |
61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
对 | 错 | 错 | 错 | 对 | 对 | 错 | 错 | 错 | 对 |
71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
对 | 对 | 错 | 对 | 错 | 对 | 对 | 对 | 错 | 错 |
81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
对 | 错 | 对 | 错 | 对 | 错 | 对 | 对 | 错 | 对 |
91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
对 | 对 | 错 | 错 | 错 | 对 | 错 | 对 | 对 | 错 |
101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 |
对 | 对 | 错 | 对 | 对 | 错 | 对 | 错 | 对 | 对 |
111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 |
对 | 错 | 错 | 对 | 对 | 对 | 对 | 错 | 对 | 错 |
121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 |
错 | 错 | 对 | 对 | 错 | 对 | 对 | 对 | 错 | 错 |
131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 |
错 | 对 | 错 | 错 | 错 | 错 | 对 | 对 | 错 | 错 |
141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 |
错 | 错 | 错 | 对 | 错 | 对 | 错 | 对 | 对 | 错 |
151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 |
错 | 错 | 对 | 错 | 对 | 对 | 错 | 对 | 对 | 错 |
161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 |
对 | 对 | 错 | 对 | 对 | 对 | 对 | 对 | 错 | 错 |
171 | 172 | 173 | 174 | 175 | 176 | 177 | 178 | 179 | 180 |
错 | 错 | 错 | 对 | 错 | 对 | 对 | 对 | 对 | 对 |
181 | 182 | 183 | 184 | 185 | 186 | 187 | 188 | 189 | 190 |
错 | 错 | 错 | 对 | 对 | 对 | 对 | 错 | 错 | 错 |
191 | 192 | 193 | 194 | 195 | 196 | 197 | 198 | 199 | 200 |
对 | 错 | 对 | 对 | 错 | 错 | 对 | 错 | 错 | 错 |
201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 |
对 | 对 | 错 | 对 | 错 | 错 | 对 | 对 | 对 | 错 |
211 | 212 | 213 | 214 | 215 | 216 | 217 | 218 | 219 | 220 |
对 | 错 | 对 | 错 | 对 | 对 | 对 | 对 | 错 | 错 |
221 | 222 | 223 | 224 | 225 | 226 | 227 | 228 | 229 | 230 |
对 | 错 | 错 | 错 | 错 | 错 | 对 | 对 | 错 | 对 |
231 | 232 | 233 | 234 | 235 | 236 | 237 | 238 | 239 | 240 |
对 | 错 | 错 | 错 | 对 | 错 | 错 | 错 | 错 | 对 |
241 | 242 | 243 | 244 | 245 | 246 | 247 | 248 | 249 | 250 |
错 | 对 | 对 | 错 | 对 | 对 | 错 | 对 | 对 | 对 |
251 | 252 | 253 | 254 | 255 | 256 | 257 | 258 | 259 | 260 |
对 | 错 | 错 | 对 | 错 | 对 | 对 | 对 | 错 | 对 |
261 | 262 | 263 | 264 | 265 | 266 | 267 | 268 | 269 | 270 |
错 | 错 | 错 | 对 | 对 | 对 | 对 | 错 | 错 | 对 |
271 | 272 | 273 | 274 | 275 | 276 | 277 | 278 | 279 | 280 |
对 | 对 | 错 | 对 | 对 | 对 | 错 | 错 | 对 | 错 |
281 | 282 | 283 | 284 | 285 | 286 | 287 | 288 | 289 | 290 |
错 | 对 | 错 | 对 | 错 | 错 | 对 | 错 | 错 | 对 |
291 | 292 | 293 | 294 | 295 | 296 | 297 | 298 | 299 | 300 |
错 | 对 | 对 | 对 | 错 | 对 | 错 | 对 | 错 | 对 |
301 | 302 | 303 | 304 | 305 | 306 | 307 | 308 | 309 | 310 |
错 | 错 | 错 | 错 | 错 | 错 | 对 | 对 | 对 | 错 |
311 | 312 | 313 | 314 | 315 | 316 | 317 | 318 | 319 | 320 |
错 | 对 | 对 | 错 | 错 | 对 | 对 | 错 | 错 | 错 |
321 | |||||||||
错 |

- 全部评论(0)
