判断金属离子强酸盐溶解时是否有氢氧化物沉淀产生的计算
时间:2020-04-14 09:37 来源:化学原理补正博客 作者:化学自习室 点击:次 所属专题: 溶度积计算 氢氧化物沉淀
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对一定浓度的含有某金属离子的溶液来说,判断其中是否有氢氧化物沉淀出现的方法其实是很简单的。因为根据溶度积规则,只要满足条件[Mn+][OH-]n≧Ksp,溶液中就会有M[OH]n沉淀生成。
要注意的是,当金属离子有较强的水解趋势时,金属离子的分析浓度c并不等于其平衡浓度[Mn+],而是[Mn+]比c要小;溶液中的[OH-]也不是纯水中的“10-7mol·L-1”,而是[OH-]比“10-7mol·L-1”也小。解决问题的关键在于,要计算出达到水解平衡时该盐溶液中[Mn+]及[OH-]的具体数值。
按酸碱质子理论,作为质子酸,当已知金属离子Mn+的Ka(可由化学手册查出)及分析浓度c时,是可以计算出其水解掉的部分,及溶液的[H+],从而得到该盐溶液中[Mn+]及[OH-],并进而做出是否有M[OH]n沉淀生成的判断的。
遵循上述的思路,可以对带电荷数不同的几类金属离子,分别举出一个计算的实例:
例1.计算0.1 mol·L-1AgNO3溶液中,在考虑Ag+水解的情况下,是否有氢氧化物沉淀生成?
解:查得AgOH的Ksp=2.0×10-8。
还查得,作为一元弱酸Ag+的PKa=11.1,即Ka=7.9×10-12(很弱的质子酸)。
这样,应该使用极弱式,来计算溶液的[H+]:
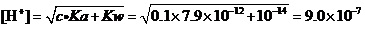 (mol·L-1)。
(mol·L-1)。
所以,溶液中的[OH-] =Kw/[H+] =1.0×10-14/9.0×10-7=1.1×10-8。
据溶度积规则,[Ag+]·[OH-] = 0.1×1.1×10-8= 1.1×10-9<Ksp=2.0×10-8。
所以,从理论上看,用纯水来配制AgNO3溶液时,不会有AgOH沉淀生成。
例2.计算0.1 mol·L-1Cu(NO3)2溶液中,在考虑Cu2+水解的情况下,是否有氢氧化物沉淀生成?
解:查得Cu(OH)2的Ksp=2.2×10-20。
还查得,作为一元弱酸Cu2+的PKa=8.0,即Ka=1.0×10-8。
可以用最简式来计算溶液的[H+]:
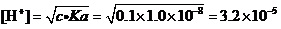 (mol·L-1)。
(mol·L-1)。
这样,溶液中的[OH-] =Kw/[H+] =1.0×10-14/3.2×10-5=3.1×10-10。
据溶度积规则,[Cu2+]·[OH-]2= 0.1×(3.1×10-10)2= 9.6×10-21<Ksp=2.2×10-20。
所以,从理论上看,用纯水来配制Cu(NO3)2溶液时,也不会有Cu(OH)2沉淀生成。
例3.计算0.1 mol·L-1Fe(NO3)3溶液中,在考虑Fe3+水解的情况下,是否有氢氧化物沉淀生成?
解:查得Fe(OH)3的Ksp=4×10-38。
还查得,作为三元弱酸Fe3+的PKa1=2.83,即Ka1=1.5×10-3(中强的弱酸);PKa2=4.59,即Ka2=2.6×10-5。
这样,应该不考虑酸的二级解离,并使用近似式来计算溶液的[H+]:
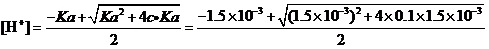 。
。
可解得[H+]=1.2×10-2。
从而求得[OH-] =8.7×10-13,[Fe3+] = 0.1-1.2×10-2=8.8×10-2。
离子积[Fe3+] [OH-]3= 8.8×10-2×(8.7×10-13)3=5.8×10-38>Ksp=4×10-38。
计算说明,用纯水来配制0.1 mol·L-1Fe(NO3)3溶液时,肯定会有Fe(OH)3沉淀生成。所以,在配制这一溶液时一定要加适量硝酸,以防止Fe3+的水解。

- 全部评论(0)
