两性离子自身间的争夺质子反应
时间:2021-11-29 19:33 来源:化学原理补正的博客 作者:伍伟夫 点击:次 所属专题: 自耦电离
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
诸如HCO3-、HPO42-类的离子,在水溶液中都可以继续电离给出质子,也可以通过水解来结合质子而产生氢氧根离子。或表现为既能与碱反应,又能与酸反应。故都可以将它们称为两性离子。
对所有两性离子来说,除上述人们熟知的电离和水解这两个性质外,还有一个经常被人们忽视的反应。在许多情况下这个反应不但较前两个反应进行的趋势更大,还远比前两个反应重要。
不了解两性离子的这个重要性质是不可以的。
一、三个反应的反应趋势比较
对HCO3-离子来说,其电离、水解及自身争夺质子反应,分别可以表述为:
 H++ CO32-……(1)
H++ CO32-……(1)
 H2CO3+OH-……(2)
H2CO3+OH-……(2)
 H2CO3+CO32- ……(3)
H2CO3+CO32- ……(3)
在这3个反应中哪个进行的趋势最大,对溶液性质的影响也最大呢?许多人都会凭化学直觉说,当然是反应(2)、也就是水解反应进行的趋势最大。因为NaHCO3溶液显碱性。
实际情况如何?还是定量一些、用这些反应的平衡常数来告诉我们吧。
反应(1)的平衡常数就是碳酸的第二级解离常数。查表得K1=Ka2=5.61×10-11;
反应(2)是碳酸第一级解离的逆反应,其平衡常数与碳酸的Ka1有关。K2=Kb=Kw/Ka1=(10-14)/(4.30×10-7)=2.33×10-8;
反应(3)的平衡常数则是碳酸的第二级与第一级解离常数的比值,
 。
。
K3大约是K2的104倍.,是K1的107倍。反应(3)是HCO3-溶液中的最主要反应。
有人认为,可以将反应(3)看做,就是反应(1)和(2)的简单组合。其实这是不可以的。
因为,如果是简单组合的话,就应该有K3=K1·K2。而在K1与K2都不大的情况下,K3理应会是更小的。实际情况K3>K2>K1,是反驳上述看法的最好证据。
再仔细一点分析可以看出,反应(3)与反应(1)和(2)还是有一定关系的。具体的关系为,反应(3)=反应(1)+反应(2)+(H+与OH的中和)反应。这个式子能解释为什么有K3>K2与K1。但不能代表反应的本质。因为反应(2)中有水的解离,它同“(H+与OH的中和)反应”间互为逆反应,是相互否定的。
考虑到HCO3-离子间直接接触的机会极少,将反应(3)理解为,是反应(2)与反应“HCO3-+ OH-= CO32-+ H2O”加合的结果,还是比较合理的。其中水仅起传递质子的作用。去掉这一水的媒介作用,本质还是2个HCO3-离子间的质子传递。结果为一个离子的H+多了、一个离子的H+少了,所以应将这类反应称为自身争夺质子的反应。
二、两性离子溶液显酸碱性的根本原因
有一些人用反应(2)HCO3-+ H2O  H2CO3+OH-是实际起作用的反应,来解释NaHCO3溶液为什么显碱性。
H2CO3+OH-是实际起作用的反应,来解释NaHCO3溶液为什么显碱性。
对中学生,这是无可厚非的,因为中学生的化学知识有限。但对一名掌握有较多化学原理的化学工作者,这样来理解NaHCO3溶液的碱性,则是一个不能被容忍和原谅的错误。
如果水解是造成溶液显碱性的主要原因。那么计算溶液的pH就应该用反应(2)的平衡常数来进行计算:
设NaHCO3溶液的浓度为0.1mol·L-1。则 。[H+]= 2.07×10-10,pH=9.68。
。[H+]= 2.07×10-10,pH=9.68。
上述计算方法及结果当然都是错误的。因为在基本化学原理教学中,我们以被告知,对两性离子溶液的[H+]计算,只能套用公式 。对NaHCO3溶液来说,它涉及的是碳酸的Ka1及Ka2。正确的计算是:
。对NaHCO3溶液来说,它涉及的是碳酸的Ka1及Ka2。正确的计算是:
 ,pH=8.31。
,pH=8.31。
两计算的差别是明显的,[H+]相差达20余倍。
绝对不能用前者代替两性物质溶液中[H+]的计算。这一事实从一个侧面也反映出了,HCO3-离子的水解并不是造成其水溶液呈碱性的主要原因。是什么原因使其溶液显碱性呢?应该通过后一计算公式的解析来告诉我们。
计算所用的公式为 ,其物理意义可以通过以下的变换体现出来:
,其物理意义可以通过以下的变换体现出来:
考虑公式根号内的两个解离常数。将解离常数表示式的具体内容写出,有 。注意到前一分式分子与后一分式分母中的[HCO3-]项可以消掉(溶液中只有1个[HCO3-]浓度)。这样只有当溶液中的[H2CO3]与[CO32-]浓度也相等,才能把这两项也消掉,而成为
。注意到前一分式分子与后一分式分母中的[HCO3-]项可以消掉(溶液中只有1个[HCO3-]浓度)。这样只有当溶液中的[H2CO3]与[CO32-]浓度也相等,才能把这两项也消掉,而成为 ,进而有正统的计算公式
,进而有正统的计算公式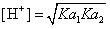 。
。
在HCO3-离子溶液中,只有在承认反应(3)HCO3-+ HCO3-= H2CO3+CO32-是主要反应、自身争夺质子反应是核心反应的前提下,才能有[H2CO3]=[CO32-]。所以,使用公式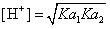 来对两性溶液进行计算,就是承认其中自身争夺质子的反应是核心反应。
来对两性溶液进行计算,就是承认其中自身争夺质子的反应是核心反应。
考虑到所有两性溶液都要用这个公式来进行相关的计算,可以认为,自身争夺质子反应都是它们的核心反应。这个结论无疑是正确的。
下面再比较两个酸碱性不同的两性离子:
NaH2PO4溶液是显酸性的。相关的计算过程和结果为 (mol·L-1)。从形式上看,是其Ka1与Ka2的乘积还较大。根本的原因还在于,自身争夺质子反应产生的两个浓度相等物种H3PO4与HPO42-,它们要求与其平衡的[H+]浓度要较大。
(mol·L-1)。从形式上看,是其Ka1与Ka2的乘积还较大。根本的原因还在于,自身争夺质子反应产生的两个浓度相等物种H3PO4与HPO42-,它们要求与其平衡的[H+]浓度要较大。
而Na2HPO4溶液的碱性,要由 (mol·L-1)来决定。其根本的原因在于,自身争夺质子反应产生的两浓度相等物种H2PO4-与PO43-,它们要求与其平衡的[H+]浓度要较小。
(mol·L-1)来决定。其根本的原因在于,自身争夺质子反应产生的两浓度相等物种H2PO4-与PO43-,它们要求与其平衡的[H+]浓度要较小。
可见,两溶液的酸碱性,与其电离、水解反应无关,与其浓度无关。只是由于其自身的争夺质子反应在起主导作用。
三、两性离子溶液的酸碱支配区图
两性离子自身的争夺质子的反应在酸碱支配区图中也有很清楚的反应[1] [2]。
酸碱支配区图有一个重要的性质,就是其pH轴上的每一点,都能反映出某状态下共轭酸碱物种间的浓度比。
如下图中pH=2.12的A点,也就是H3PO4的PKa1标志点。在这一点上,也就是pH= PKa1时,由 ,肯定有[H3PO4]:[H2PO4-]=1:1,即两物种各占50%。
,肯定有[H3PO4]:[H2PO4-]=1:1,即两物种各占50%。
而在其右侧pH=3.12的B点,也就是与A正好相差1个pH值的点([H+]为A点的1/10),肯定有[H3PO4]:[H2PO4-]=1:10。在这点[H2PO4-]>[H3PO4],所以也把这个区域标记为H2PO4-的支配区。
不难知道,在pH=4.12的点C(未在图中标出),与A正好相差2个pH值的点([H+]为A点的1/100),肯定有[H3PO4]:[H2PO4-]=1:100。

与上面的分析相似,pH=7.21的D点是H3PO4的PKa2标志点。代表的是[H2PO4-]:[HPO42-]=1:1。
而由D点向左1个pH单位的pH=6.21的E点,显然在H2PO4-的支配区内,代表着[HPO42-]:[H2PO4-]=1:10。将E点与另一状态点B比较,可以看出有[HPO42-]:[H2PO4-]=[H3PO4]:[H2PO4-]=1:10。即在这两个状态时其[HPO42-]=[H3PO4],且它们都是[H2PO4-]的1/10。
在pH=5.21的F点(比E点再向左1个pH值单位、图中也未画出),当然与C点(未画出)有关,两点的[HPO42-]=[H3PO4],且它们都是[H2PO4-]的1/100。
这样不难得出,A与D的中点G=4.67的点,是一个真正的[HPO42-]=[H3PO4]的状态点。即如果溶液中[HPO42-]=[H3PO4],其pH一定要等于4.67。且该点的pH可以用 的方法来计算。由这一对数计算式可以很容易地转换为通常的
的方法来计算。由这一对数计算式可以很容易地转换为通常的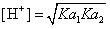 。
。
四、两性离子自身争夺质子反应的表现
两性离子在与其它物种发生化学反应时,也常常表现出其自身争夺质子的性质。不了解这一点,就很难把握这类反应的本质。
如,Na2HPO4与适量AgNO3溶液的反应。本质是Ag+离子与PO43-离子结合生成难溶的Ag3PO4。反应为3 Ag++ PO43-= Ag3PO4。
为提供出足够多的PO43-离子,HPO42-离子一定要发生自身争夺质子反应2 HPO42-= H2PO4-+ PO43-。
将这两个反应简单地相加,就有3 Ag++2 HPO42-= H2PO4-+ Ag3PO4。
化学方程式为3 Ag NO3+2 Na2HPO4=3 Na NO3+Na H2PO4+Ag3PO4……(4)
如,继续再滴加入AgNO3溶液,H2PO4-离子会继续发生自身争夺质子反应3 H2PO4-= 2H3PO4+PO43-(由于PO43-被Ag+沉淀掉,这一反应也会进行的相当完全)。从而有3 H2PO4-+3 Ag+= 2H3PO4+Ag3PO4。
化学方程式为3 Ag NO3+3 NaH2PO4=3 Na NO3+2 H3PO4+Ag3PO4……(5)
将式(4)×3与(5)相加,还可以得到Na2HPO4与足量AgNO3溶液的反应方程式;
6 Ag NO3+3 Na2HPO4=6 Na NO3+H3PO4+2Ag3PO4……(5)
尽管在不断滴加AgNO3的反应过程中,Na2HPO4溶液的酸性要增强(开始只是NA2HPO4溶液,逐渐变成Na H2PO4溶液,最后成H3PO4溶液)但始终都不会有H+生成,也就是无强酸HNO3生成。
参考文献
[1]
[2]伍伟夫.酸碱支配区图在化学教学中的应用.化学教育. 2008年第8期

- 全部评论(0)
