第十九讲:分子结构与性质(一)共价键分子结构
时间:2021-04-16 11:06 来源:高中化学教学研究 作者:张德金 点击:次 所属专题: 共价键 分子结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

从微观角度来说,化学反应除了有原子、单原子离子参与反应之外,还有多原子分子、多原子离子参与反应。
而分子的性质的体现,不仅与组成分子的原子有关,也与分子的结构有关。分子的结构既有共价键的作用,也有立体构型的作用。
这一部分专门研究分子的结构与性质之间的关系。(包括多原子离子)
一、共价键
1、共价键的分类
在分子中,原子之间的作用力是共价键。共价键以形成共用电子对的形式产生作用力。
根据形成共价键的各电子对的重叠方式不同,共价键细分为σ键、π键、δ键等。
(1)σ键:两个原子轨道沿键轴(两原子核间连线)方向以“头碰头”方式重叠所形成的共价键,叫做σ键。
根据组成σ键的两个轨道的不同,又分为s-s σ键(如H2)、s-p σ键(如HCl)、p-p σ键(如Cl2)。

由于σ键电子云的重叠程度大,相互作用力强,所以稳定性高。
σ键有轴对称特征。
(2)π键:成键原子的p轨道,垂直于键轴,以“肩并肩”方式重叠所形成的化学键称为π键。

由于π键电子云的重叠程度不大,相互作用力不强,所以稳定性差一些。在发生反应时,容易比σ键先断裂。
π键有镜面对称特征。
例如乙烯中的碳碳双键C=C:含有一个σ键和一个π键。

乙烯的碳碳双键中的π键不稳定,所以乙烯易发生加成反应。
共价单键只有一个σ键。共价双键有一个σ键和一个π键。共价三键有一个σ键和两个π键。下面是乙炔的两个π键。

(3)δ键:由两个d轨道面对面四重交叠而形成的共价键称为δ键。

δ键常出现在有机金属化合物中。通常所说的“四重键”指的就是一个σ键、两个π键和一个δ键。
2、离域π键
(1)在多原子分子中如果有多个相互平行的p轨道,它们连贯重叠在一起构成一个整体,平行p轨道上的电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或共轭大π键,简称大π键。离域π键具有特殊的稳定性。
离域π键通常用Пab来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。
例如苯有离域π键,苯的离域π键表示为П66。苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的,既不是单键,也不是双键。所以苯的化学性质显现为芳香烃的性质,不易发生加成和氧化反应,易发生取代反应。

又如石墨的每一层都有一个无穷大的π键,平行p轨道的电子在这个超大π键中可以自由移动,这也是石墨可以导电的原因。

(2)离域π键的p轨道的数目和电子数目的推理方法:
离域π键的推理方法是基于路易斯理论,在本问题中,每个原子周围的“共价键数+1+孤电子对数”=4。共价键数包括σ键数和π键数的和。离域π键也是原子的一个键。
以计算NO2为例

①先用单键画出分子的简单连接关系。
②再用灰色箭头,在每个形成离域π键的原子上将离域π键标出。
能形成离域π键的原子的判断方法是,它的周围的键总数<它的应成键数(8-价电子数),它就会有离域π键。但中心原子不管有几个键,它肯定有离域π键。
③根据每个原子周围的“共价键数+1+孤电子对数=4,画出每个原子的孤对电子。
④计算每个原子上的剩余电子。计算式为:价电子数-共价键数-孤电子对数×2。
N的剩余电子数=5-2-1×2=1。
O的剩余电子数=6-1-2×2=1。
所以NO2的离域π键用П33来表示,有3个原子和3个电子。
下面是NO3-的离域π键推理图示:

NO3-的离域π键为П46型。
离域π键会导致参加形成大π键的原子在同一个平面内。(这个现象不是绝对的),所以NO3-的四个原子在同一个平面内,呈平面三角形。
下面是叠氮酸的推理图示:
HN3的离域π键为П34型。

3、配位键
它是一种特殊的共价键,又称配位共价键。当共价键中的共用电子对是由其中一个原子独自提供,另一个原子只提供空轨道时,就形成配位键。配位键形成后,就和一般的共价键无异。
例如NH3分子形成NH4+。

配位键在书写结构式时,用箭头表示,从电子对的给予方指向接受方。
通常把金属离子或原子与某些分子或离子(称为配体)以配合键结合形成的化合物称为配位化合物,简称配合物。如Fe(SCN)3就是配位化合物。
Cu2+是无色的,溶于水后却显示为蓝色,原因是Cu2+与4个H2O形成[Cu(H2O)4]2+。蓝色Cu(OH)2沉淀能溶于氨水中,形成深蓝色溶液。发生的反应为
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH‑
其中[Cu(NH3)4]2+的结构式为:

配位键的强度有大有小,形成的配合物有的很稳定,有的很不稳定。过渡金属元素配合物比主族元素配合物要多。
4、共价键的饱和性和方向性
(1)共价键的饱和性:
在共价键的形成过程中,由于每个原子所能提供的未成对电子数是一定的,一个原子的未成对电子与其他原子的未成对电子配对后,就不能再与其它电子配对,每个原子能形成的共价键总数是一定的,这就是共价键的饱和性。
原因类似于能量最低原理和泡利原理。
我们平时在书写常见物质的电子式及推理化学键的形成时,经常采用的规则是,原子最外层达到8电子时是稳定结构(氢为2),缺几个电子会形成几对共用电子对。这种理论叫路易斯理论,又叫八隅体规则。这种规则实际上就是利用了共价键的饱和性。

氧原子利用路易斯理论形成氧分子
(2)共价键的方向性:
影响共价键的方向性的因素为轨道伸展方向。下图为乙炔分子的共价键,可以看出键的方向性及原因。


除了s电子以外,其它电子云都是有空间取向的,在成键时,要尽可能沿着电子云密度最大的方向发生重叠。例如H2O中,氢原子的1s电子云沿着氧原子的2Px、2Py电子云的空间伸展方向的重叠,才能达到电子云重叠程度最大,形成稳定的共价键,因此共价键具有方向性。共价键的方向性决定着分子的立体结构。
5、共价键的键能、键长、键角及与性质之间的关系。
(1)键长:形成共价键的两个原子的核间距,单位pm(1×10-12m)。
注意键长与原子半径、共价半径之间的区别:键长不是原子半径的加和。

A为原子半径,B、B'、B"为共价半径,C、C'为键长。
键长主要与两个因素有关。一个是组成共价键的两个原子的大小,原子半径越大,键长越长。
| 键 | 键长 | 键 | 键长 |
F-F | 141 | Cl-Cl | 198 |
Br-Br | 228 | I-I | 267 |
另一个是两个原子之间形成的共用电子对数,共用电子对数越多,作用力越强,键长越短。
| 键 | 键长 | 键 | 键长 |
C-C | 154 | C=C | 133 |
C≡C | 120 |
(2)键能:两种气态基态原子形成1mol 化学键释放的最低能量,单位是kJ/mol。
键能越大,形成键时释放的能量越大,化学键越稳定。越不容易断键。所以对应的分子的稳定性越高。
键 | 键能 | 键 | 键能 |
H-F | 568 | H-Cl | 431.8 |
H-Br | 366 | H-I | 298.7 |
HF、HCl、HBr、HI的稳定性越来越低。
键能主要与两个因素有关。一个是键长越长,键能越小。另一个是共用电子对数越多,键能越大。
| 键 | 键能 | 键 | 键能 |
C-C | 347.7 | N-N | 193 |
C=C | 615 | N=N | 418 |
C≡C | 812 | N≡N | 946 |
但不能认为,键长越短,键能越大,这个键参加各种反应就越困难。比如,C=C比C-C的键长短,键能大,但C=C比C-C更容易被氧化,更容易发生加成反应。
将键长和键能一起看,键长和键能有着很强的必然联系。
(3)键角:同一个原子上所连两个共价键之间的夹角。描述键角就像数学中描述一个角类似。
例如,H2O中,H-O-H键角为105°。
键角与原子的轨道空间状态有关,影响着分子的结构。
键角会影响到物质的性质,如物理性质中,冰的密度比水的低。
化学性质中,丙烯与HCl的加成产物以2-氯丙烷为主,以1-氯丙烷为次。高分子的手性反应,也与键角有关。



丙烯与HCl的加成
二、分子的立体结构
1、简单分子及多原子离子的立体结构及推理方法
(1)根据路易斯理论中的8电子稳定结构,每个原子周围有4对电子。
如果这4对电子相互独立,则电子云如下图中的A。如果这4对电子有2对合并,则电子云如下图中的B,
如乙烯中的 。如果这4对电子两两合并或有3对合并,则电子云如下图中的C,如CO2中的=C=,或乙炔中的—C≡。
。如果这4对电子两两合并或有3对合并,则电子云如下图中的C,如CO2中的=C=,或乙炔中的—C≡。

(2)用上面的电子云的三种可能,再根据中心原子形成共价键需要的原子数,就会形成下面这些可能。



(3)分子的立体构型
分子 | 立体构型 | 键 | 键能 |
CO2 | 直线形 | C2H2 | 直线形 |
H2O | V形 | HHO | 平面三角形 |
NH3 | 三角锥形 | CH4 | 正四面体形 |
像一些非金属单质、各种简单的烃、一些简单的烃的衍生物、碳酸及盐等,都可以用上面的理论推理出分子或离子的立体结构。

碳酸及其盐的阴离子的立体结构
2、复杂分子及多原子离子的立体结构及推理方法——VSEPR理论
路易斯理论的局限性在于,有些分子中的原子周围不是8个电子,有6个的,有10个的,有12个的,这样就无法用上面的理论进行推理。这就需要一种涵盖更广的理论。
(1)价层电子对互斥理论(VSEPR theory):用它可以进行更宽泛地推理分子的立体结构。(ValenceShell Electron Pair Repulsion Theory)
它的基本说法有:
①分子的立体构型是价层电子对相互排斥的结果。
②价层电子对是指中心原子上的一部分电子对,包括σ键电子对和孤电子对(也就是除了π键电子对)。
甲烷的C上有四个σ键,价层电子对有4对。乙烯的C上有三个σ键和一个π键,价层电子对有3对。乙炔的C上有两个σ键和两个π键,价层电子对有2对。C原子周围的价层电子对的电子云分布分别如下

③“σ键电子对”数目的确定方法:用中心原子周围的原子个数判断即可。
有的很简单,像H2O、NH3、CH4。
有的并不简单。如HHO,C是中心原子,C周围的原子数有3个,用结构简式并不能直接看出。所以还需要知道结构式,或用路易斯理论和电子式的书写方法来做推理。
又如H2SO4中的两个H连在O上,不连在S上,这个用路易斯理论和电子式的书写方法也推理不出来。所以VSePr理论有一定的难度。
④“孤电子对”数目的确定方法:
中心原子的孤电子对数=1/2(中心原子的价电子数-周围相连原子的缺电子数)
如果是多原子离子,则价电子数计算要考虑得失电子。若存在配位键,则要考虑配位键电子对由谁提供。
例如SO2,中心原子是S,价电子数是6,每个O需要的电子数为2,孤电子对数=1/2(6-2×2)=1。所以SO2的孤电子对数为1,σ键电子对数为2,价电子对数=2+1=3。
PCl5,中心原子是P,价电子数是5,每个Cl需要的电子数为1,孤电子对数=1/2(5-5×1)=0。所以PCl5的孤电子对数为0,σ键电子对数为5,价电子对数=5+0=5。

PCl5的立体构型(正六面体)
例如SO42-,中心原子是S,价电子数是6。四个O中有两个O需要的电子数为2,另外两个O已经各得1个电子,需要的电子数为1。孤电子对数=1/2(6-2×2-2×1)=0。所以SO42-的孤电子对数为0,σ键电子对数为4,价电子对数=4+0=4。
例如NH4+,中心原子是N,价电子数是5。四个H中有三个O需要的电子数为2。另外一个H是配位键,需要两个电子。孤电子对数=1/2(5-3×1-2)=0。所以NH4+的孤电子对数为0,σ键电子对数为4,价电子对数=4+0=4。
例如NO2,中心原子是N,价电子数是5。两个O需要的电子数为4。孤电子对数=1/2(5-2×2)=0.5。0.5意味着也有孤电子,这个孤电子不是一对,但要占用一个轨道,所以要算做1个孤电子对。σ键电子对数为2,价电子对数=2+1=3。
(2)价层电子对数与价层电子对空间分布之间的关系

HCl的Cl上的价层电子对有4对,H2O的O上的价层电子对有4对,NH3的N上的价层电子对有4对,CH4的C上的价层电子对有4对。它们的中心原子的σ键电子对和孤电子对的分布情况如下:

(3)VSEPR模型与分子立体构型之间的关系
分子立体构型是VSEPR模型去掉孤电子对后的空间形状。

VSEPR模型

分子的立体构型
注意VSEPR模型名称和分子立体构型名称不同。例如,NH3的VSEPR模型名称为正四面体形,分子的立体构型为三角锥形。
3、解释分子立体结构的另一种理论——杂化轨道理论
不管用路易斯理论,还是VSEPR理论,都存在一个问题没有解决。那就是原子周围的4对电子,有一对是s轨道的,有三对是p轨道的,它们的空间分布状态并不相同,那么它们的电子云的空间分布,不能是正四面体形。
而我们实际测得的CH4的立体构型是正四面体形。这说明C周围的四对电子的空间分布是完全相同的。为了解决这个问题,鲍林提出了杂化轨道理论。
(1)杂化轨道理论
①在成键的过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化,杂化后形成的新轨道称为杂化轨道。
②杂化轨道有利于原子轨道间最大程度地重叠,所以杂化轨道比原来轨道的成键能力强。杂化轨道之间在空间中取最大夹角分布,使相互间的排斥能最小,形成的键较稳定。
③有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
杂化轨道的数目=VSEPR中的价层电子对数。
同样,杂化轨道的数目与σ键电子对和孤电子对有关,与π键电子对无关。
④杂化方式的描述方法:与参与杂化的轨道类型及数目有关。
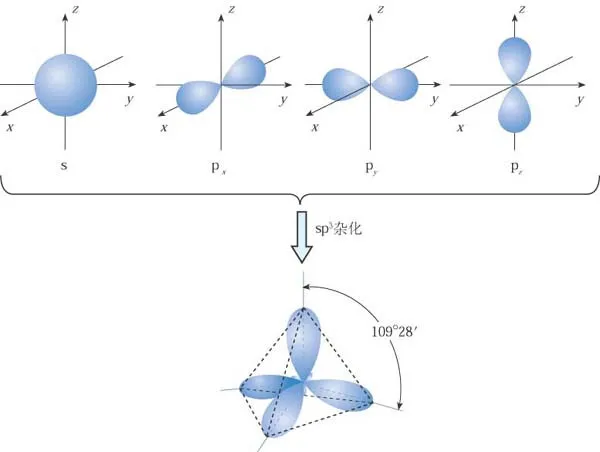
若有一个s轨道与三个p轨道发生杂化,则叫sp3杂化。如H2O、NH3、CH4。
若有一个s轨道与两个p轨道发生杂化,则叫sp2杂化。如C2H4、HHO、BF3。
若有一个s轨道与一个p轨道发生杂化,则叫sp杂化。如C2H2、CO2。
以下为甲烷的sp3杂化、乙烯的sp2杂化、乙炔的sp杂化:

sp3杂化
sp2杂化、sp杂化
若有一个s轨道与三个p轨道、一个d轨道发生杂化,则叫sp3d杂化,如PCl5。(次外能层全充满时)
若有一个s轨道与三个p轨道、两个d轨道发生杂化,则叫sp3d2杂化,如SF6。

还有dsp3、d2sp2、d2sp3等杂化方式。d写在前面,指上一能级的d轨道与下一能级的s轨道、p轨道进行杂化。(次外能层没有全充满时)
d写在后面,指同一能级的s轨道、p轨道、d轨道进行杂化。
⑤杂化过程中采用的轨道和参与的电子数的问题
以C原子的sp3、sp2、sp杂化为例

sp3杂化需要4个轨道,2s能级和2p能级上共4个轨道都参与杂化。

sp2杂化需要3个轨道,2p能级上要保留1个轨道和1个电子用于形成π键。

sp2杂化需要2个轨道,2p能级上要保留2个轨道和2个电子用于形成2个π键。
讲解这种分析方法的原因是,有些杂化轨道利用的轨道和电子比较复杂,有利用空轨道或满轨道杂化的,也有单方对外提供电子或接受电子的,需要分析才能知道。
【练习】
1、写出
(1)碳碳三键中的共价键种类和数目。
(2)CO2中有σ键 个,π键 个,孤对电子 对。
(3)CH2=CH2中有s-p σ键 个、p-p σ键 个,π键 个,
(4)四重键中有σ键 个,π键 个, 键1个。
(5)σ键和π键, 更稳定。
2、苯的离域π键可以表示为 。推理SO3的离域π键类型为 。
3、用8电子稳定(路易斯理论)推理SO42-中配位键的数目: 。
4、组成共价键的两个原子的原子半径加和是否是键长? 。
5、共价键的键能大小主要由哪两个因素决定? 。
6、写出下列分子的立体构型
CH4 。NH3 。H2O 。CO2 。HCHO 。
7、用VSEPR理论推理
(1)SO3的VSEPR模型名称为 、立体构型名称为 。
(2)SO42-的VSePr模型名称为 、立体构型名称为 。
8、用VSEPR理论推理
(1)SOCl2的杂化类型 。
(2)CsCl2的杂化类型 。
(3)PCl5的杂化类型 。
【练习答案】
1、(1)σ键一个、π键两个。(2)2,2,4。(3)4,1,1。(4)1,2,δ。(5)σ键。
2、П66。П46。
3、2。
4、不是。
5、键长和共用电子对的数目。
6、正四面体形、三角锥形、V形、直线形、平面三角形。
7、(1)平面三角形,平面三角形。(2)正四面体形,正四面体形。
8、(1)sp3(2)sp2(3)sp3d

- 全部评论(0)
