关于化学键问题的讨论
时间:2021-11-02 09:49 来源:未知 作者:王笃年 点击:次 所属专题: 化学键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、化学键属于“强相互作用”还是“电磁作用"?
自然界共存在4类作用力:强相互作用(主要是指原子核内质子、中子等基本粒子之间的结合作用)、 弱相互作用(主要是指中子衰变、质子与电子和中微子结合过程中表现出的作用)、电磁作用(我们熟知的电荷之间同性相斥、异性相吸,近则强、远则弱的静电作用)、万有引力。
化学学科领域内的研究只涉及上述其中一类作用力:电磁作用、强相互作用、弱相互作用均属于核物理学研究的范畴,而万有引力则主要用于研究天体之间的作用。
那么,为什么会产生上述“化学键是不是强相互作用”的问题呢? 一般化学教科书里都把“化学键”定义为“相邻原子间发生的强烈的相互作用”,这里的 “强烈的相互作用”不可简化为“强相互作用”,它是相对于分子间作用力(包括氢键)等较弱的电磁作用而言的。
2、Na+、Cl-相互作用形成离子键后,各自的电荷 被“中和”了吗?
显然没有,在固体NaCl里还是存在Na+、Cl-的. 试想,Na+、Cl-若真的发生了“电荷中和”将意味着什么?意味着Cl-把它之前夺来的1个电子还给了 Na+ ,它们分别被还原为原子状态,NaCl作为化合物也就不存在了。
因为Na+在与1个Cl-作用、形成离子键后,正电荷依然存在,它还可以与从另一个方向靠近的Cl-发生完全同样的静电作用,并最终形成同样的离子键。所以,离子键没有饱和性和方向性,事实上,在常温下的食盐晶体内部,每个Na+都与6个Cl-之间形成 离子键,而每个Cl-也都与6个Na+之间形成离子键,并不存在独立的“NaCl”小分子。
3、 能不能根据化学式判断一种化合物属于共价化合物还是离子化合物?
严格地说,不能,除非该物质的属性是你已经知道的,如我们熟知的NaCl、Na2SO4属于离子化合物, 而H2O,CO2则属于共价化合物。
对于大多数二元化合物来说,无机化学里给出了 一个依据元素“电负性差”判断键型的经验规则:如果 2种元素的电负性差值大于1.7,则形成离子键,比如 NaCl,Na 的电负性 0. 9,Cl 的电负性 3. 0,3. 0 - 0. 9 =2.1>1.7,所以NaCl中形成的是典型的离子键。如果 2种元素的电负性差值小于1. 7,则形成共价键,比如 HCl, H的电负性2. 1, Cl的电负性3.0,3.0-2. 1 = 0. 9<1.7,所以HCl中形成的是典型的共价键;再比如AlCl3,Al的电负性是1. 6,Cl与Al的 电负性差为3. 0—1. 6 = 1. 4<1. 7,所以AlCl3中形成 的是共价键。
但是该经验规律并不能机械套用,比如HF,F的 电负性4.0,F与H的电负性差为4.0-2.1 = 1.9> 1. 7,但HF中形成的并非离子键,而是共价键。
其实,离子键和共价键只是我们研究物质结构的 2个认识模型,并不存在纯粹的离子键,为什么这么说呢?
我们知道,共价键是指相邻原子间通过电子云重叠形成的化学键,由于电子云并没有严格的边界,即使 在典型的离子化合物NaCl中,2个原子(离子)间也存在一定程度的电子云重叠,所以其化学键也具有共 价成分。参看图1.

2个球(阴、阳离子)相切关系是人们构造的离子键模型,而电子云重叠关系则是人们构造的共价键模型。
那么,2个阴、阳离子若发生相互作用,是否一定形成离子键呢?
这也不一定,举例来说,H+与OH-发生中和反应,形成的化合物是H2O。显然H2O是共价化合物而非离子化合物。同样道理,Al3+与Cl-在一定条件下结合形成的AlCl3也不是离子化合物,而是共价化合物。
4、离子键和共价键都是静电作用,哪一个相对强 —些?
这个不可一概而论,从离子键、共价键的本质属于静电作用来看,影响这些键强弱的因素主要有2个: 距离因素和电荷因素。
对于离子键来说,离子所带电荷越多、离子半径 越小,则所形成的离子键强度越大。比如,NaCl的熔点(801 °C)高于KCl (745 °C),因为K+半径比Na+略大,故同样与Cl-成键,KCl中离子键强度略弱;再如 MgO的熔点(2 800 °C )远高于NaCl,主要由于 Mg2+,O2-均带2个单位电荷,而Na+、Cl-均只带1个单位电荷,故MgO中离子键强度高于NaCl中离子键强度。
对于共价键来说,其“电荷因素”即共用电子对数,“距离因素”则指键长(成键2个原子核之间的距离)。比如N原子,其电负性与Cl几乎相等,这说明N原子应该是非常活泼的,可是N2在化学反应中却表现出近乎惰性,就是因为N2分子中存在3个共用电子对导致2个原子间结合紧密,不易拆开成为原子去参加化学反应;HF、HCl、HBr、HI的热稳定性依次减 弱,则主要由于它们分子内的键长增大、共价键强度减弱的缘故。
5、2个球形的氯原子之间通过共价键结合形成氯分子,其共价键还有方向性吗?
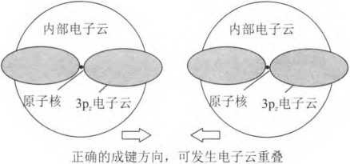
当然有,共价键是成键原子间通过电子云重叠作用形成的,要使键牢固、稳定,就要尽可能多地发生重叠,由于Cl原子的单电子在3pz轨道上,故一般认为, Cl2分子中2个Cl原子是利用3pz轨道重叠成键的,p 轨道在空间的分布不像s轨道那样均匀,而是呈纺锤形,因内层的1s、2s、2p以及3s轨道的存在,3p轨道只有部分暴露在外面,故2个Cl原子的3pz轨道只有沿着其轨道对称轴的方向相互靠近,才可能形成最大程度的电子云重叠,这样形成的Cl-Cl共价键才是最稳定的。参见图2.


- 全部评论(0)
