常见工业物质的制备
时间:2023-04-12 20:19 来源:未知 作者:化学自习室 点击: 次 所属专题: 化工流程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氯碱工业
1、反应原理:

2、反应装置图:

(1)电极反应

(2) 离子反应方程式:

3、 阳离子交换膜的作用:阻止OH-进入阳极室与Cl2发生副反应:

阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸
4、;生成物的用途:

(1)制盐酸
(2)制漂白粉:
![]()
(3)氢气:冶炼金属,绿色能源
(4)氯气:合成农药,制漂白粉,漂白液
(5)氢氧化钠:造纸、玻璃、肥皂以及纺织等
5、一种清洁、低成本的三步法氯碱工艺工作原理的示意图

(1)第一步、第三步为电解池,第二步为原电池,第一步中氧气在阴极得到电子发生还原反应生成氢氧根离子、 在阳极失去电子发生氧化反应生成
在阳极失去电子发生氧化反应生成 ,目的是用于生产氢氧化钠
,目的是用于生产氢氧化钠
(2)第二步中 在正极得到电子发生还原反应生成
在正极得到电子发生还原反应生成 、氯离子作用下银在负极失去电子发生氧化反应生成氯化银,目的是用于提取钠离子和氯离子
、氯离子作用下银在负极失去电子发生氧化反应生成氯化银,目的是用于提取钠离子和氯离子
(3)第三步中氯化银在阴极得到电子发生还原反应生成银和氯离子、氯离子在阳极失去电子发生氧化反应生成氯气,目的是用于生产氯气
二、工业制取硫酸
1、装置:沸腾炉、接触室、吸收塔
2、反应原理:

3、反应装置图:

4、解决三个问题
(1)黄铁矿充分燃烧
(2)充分利用热量
(3)解决SO3吸收时的酸雾问题
5、工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:

(1)沸腾炉中发生反应的化学方程式为

该反应属于氧化还原反应
(2)利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为

(3)从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:将该气体样品通入适量酸性高锰酸钾溶液(或通入适量品红溶液中),若溶液褪色(或颜色变浅),说明含有SO2
(4)浓硫酸在常温下可用铁制容器盛放,原因是常温下铁与浓硫酸发生钝化生成致密的氧化膜,阻止铁与硫酸继续反应
三、工业制取硝酸
1、反应原理:

2、装置设备:氧化炉、吸收塔
3、反应装置图:

4、所需试剂
(1)吸收剂:水或稀硝酸
(2)浓缩剂:硝酸镁或浓硫酸
(3)尾气吸收吸收剂:氢氧化钠溶液
![]()
5、注意事项:
在吸收反应进行过程中补充一些空气,使吸收生成的NO再氧化为NO2,NO2溶于水又生成硝酸和NO,经过多次的氧化吸收,二氧化氮可以完全的被水吸收,能尽可能多的转化成硝酸。因此起始物质和反应终产物物质的量间转化关系为:1molNH3~3mol HNO3
6、下图为工业合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为:
![]()
(2)工业生产中为了储运大量浓硝酸,最好选择铝作为罐体材料,因为铝遇浓硝酸会钝化
(3)与氮氧化物有关的全球或区域性大气环境问题有酸雨已经光化学烟雾
(4)人们开发了溶液吸收、催化还原等尾气处理方法。请以尾气中的NO2处理为例,写出相关反应的化学方程式:纯碱溶液吸收法:(提示:NO2与纯碱溶液反应可发生歧化生成两种盐)


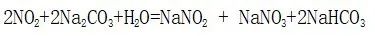
四、工业合成氨
1、反应原理:
![]()
(催化剂:还原铁粉)
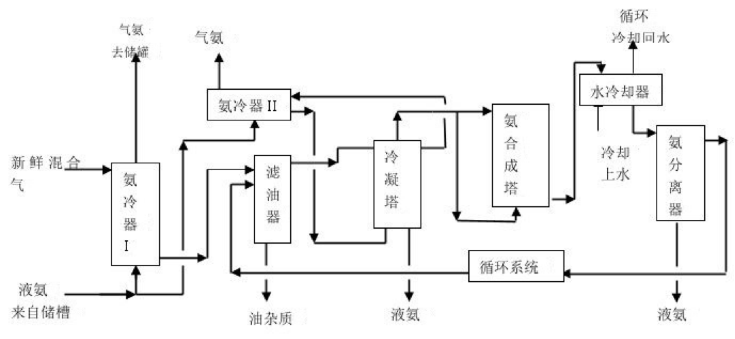
2、反应流程图:
五、从海水中提取镁(活泼金属冶炼:电解法)
1、流程图
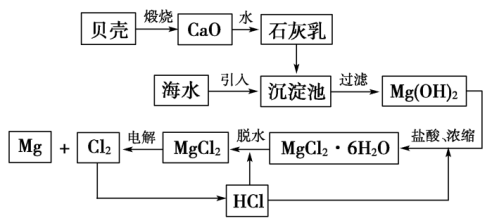
2、基本反应
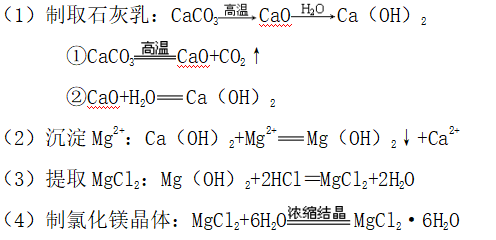
(5)氯化镁晶体脱水:
HCl的作用:抑制MgCl2的水解,得到无水MgCl2
![]()
(6)制金属镁
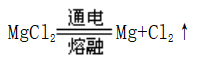
六、从铝土矿中提取铝(活泼金属冶炼:电解法)
1、酸溶法(先酸后碱)
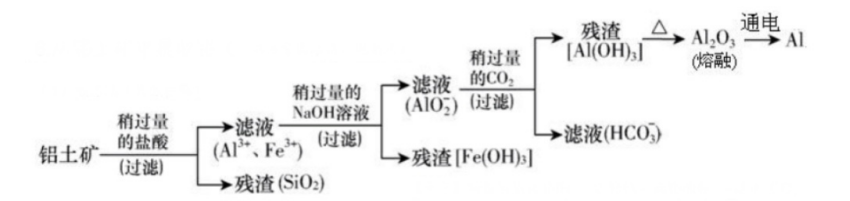
2、碱溶法(先碱后酸)
反应流程图(试剂a为盐酸;试剂b为氨水)
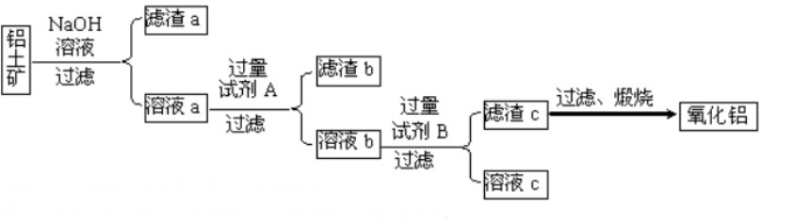
七、高炉炼铁(较活泼金属冶炼:热还原法)
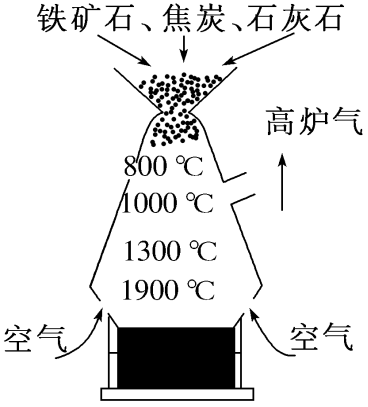
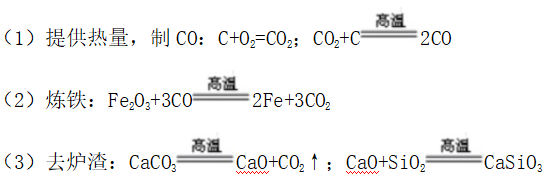
(1)炼铁的炉料(铁矿石、焦炭、石灰石等)由高炉的顶部投入,原料在下降过程中与高炉气气流在炉身部分发生作用
(2)焦炭在炼铁的过程中所起的作用是既提供热量,又产生还原剂CO
(3)采用炉料从上部加入,热空气从下部通入的工艺,其目的是采用逆流接触操作,使铁矿石与还原性气体充分接触、反应
八、炼铜
1、湿法炼铜:
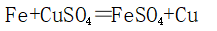
2、高温炼铜
(1)工业上用高温冶炼黄铜矿的方法获得粗铜
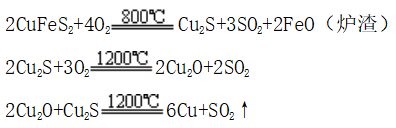
(2)电解精炼铜:用粗铜做阳极,失电子变为Cu2+,用纯铜棒做阴极即可得精铜
九、侯氏制碱法
1、流程:饱和![]()
2、原理:利用NaHCO3的溶解度小,析出晶体
3、反应

4、循环利用的物质:CO2
5、制取NaHCO3的装置


- 全部评论(0)
