怎样制乙烯最方便?
时间:2023-04-28 10:49 来源:未知 作者:范汝广 点击:次 所属专题: 乙烯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
实验室制乙烯最传统的方法是“乙醇+浓硫酸”,为此,我曾创作了一首诗进行总结:
酒精之中加硫酸,
体积之比一比三,
防沸瓷片放几粒,
液体内插温度计,
迅速升温一百七,
目的是为制乙烯,
硫酸催化兼脱水,
反应类型是消去。
在课程标准中,必修阶段要求“能描述乙烯的主要化学性质及相应性质实验的现象”,选必阶段要求理解乙醇的消去反应。
4种版本的教材在必修阶段都没有安排这个实验,在选修阶段的处理是这样的:沪科版和鲁科版只介绍了乙醇的消去反应,而没有安排演示实验,人教版和苏教版都安排了演示实验,人教版是浓硫酸作催化剂,苏教版是P2O5作催化剂。
必修阶段虽不要求掌握实验室制乙烯,但老师在演示乙烯性质时总要有乙烯吧。怎样制乙烯最方便呢?我的经验是:
最不好的方法是“浓硫酸+乙醇”,尽管它很经典。缺点主要有:反应物有腐蚀性、副反应多、生成的气体含SO2等。
用“乙醇+固体催化剂”要比上述方法方便些,这里的固体催化剂可以是P2O5、Al2O3、AlCl3等。反应装置如下:

最方便的方法是“乙烯利+氢氧化钠”,氢氧化钠可以是固体,也可以是浓溶液。这种方法操作简单,生成的气体纯净,产生气体的速率适中,可以随用随制。另外,乙烯利的价格很便宜,网上售卖的500 mL装的40%乙烯利的价格还不到30元。反应装置如下:

题干:乙烯利是一种常用的植物生长调节剂,市售乙烯利的质量分数约40%。乙烯利的结构简式为:

当pH<3.5时,乙烯利在水溶液中能稳定存在,pH升高到4.1时会释放出乙烯。
【基础型问题设计】(供高一使用)
1.某同学用pH试纸测质量分数为40%乙烯利的pH,可能的数据是( )
A.2 B.5 C.7 D.10
答案:A(由信息可知,当pH<3.5时,乙烯利在水溶液中能稳定存在。)
2.用乙烯利与氢氧化钠固体反应可迅速生成乙烯,下图进行的是乙烯的性质实验:
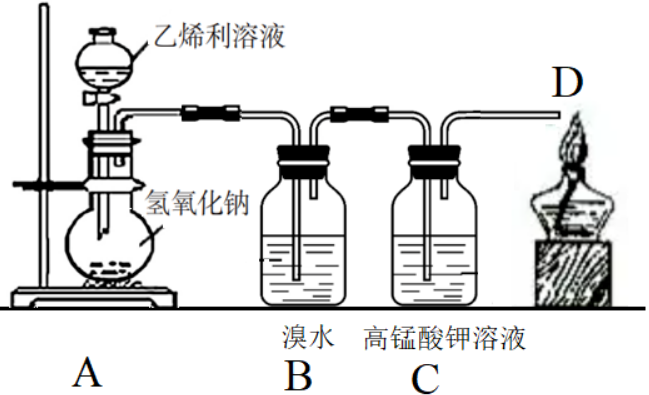
(1)写出B处反应的化学方程式 。
(2)C处的现象为 。
(3)D处的作用是 。
答案:(1)CH2=CH2+Br2→CH2BrCH2Br (2)溶液的紫红色褪去 (3)除去尾气中的乙烯
3.乙烯具有可燃性,但工业上一般不用乙烯作燃料,原因是。
答案:首先,乙烯是很宝贵的化工原料,用它可以生产更加有用的产品;其次,乙烯含碳量较高,燃烧时伴有少量黑烟。
【能力型问题设计】(供高三使用)
1.涉及P、Cl、O等元素的与原子结构、电子排布、元素周期律、化学键相关的问题设计。(略)
2.把乙烯利加水冲稀到pH大于4.1时,会释放出乙烯,该反应的化学方程式为 。
答案:
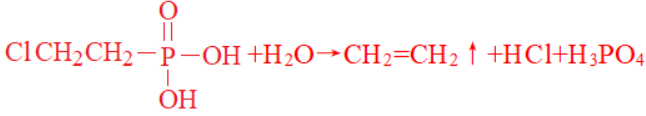
3.如图所示

(1)装置A中反应的化学方程式为 。
(2)装置B中的现象是 ,
反应类型为 。
(3)装置C中,乙烯被酸性高锰酸钾氧化为CO2,写出并配平该反应的化学方程式 。
(4)实验发现,在装置C中溶液褪色的过程中,D处管口的火焰断断续续,但当C中溶液完全褪色后,D处管口有持续的较大火焰。试解释其原因 。
答案:(1)

(2)溴水褪色加成反应
(3)5C2H4+12KMnO4+18H2SO4=10CO2↑+6K2SO4+12MnsO4+28H2O
(4)在装置C中溶液的褪色过程中,会产生CO2,可能还有装置内原有的空气同时从管口逸出,这些都不利于管口的燃烧。当C中溶液完全褪色后,不再产生CO2,且装置内的空气早已排尽,管口逸出的是乙烯,可以持续地燃烧。

- 全部评论(0)
