教材分析(必修二):硫及其化合物
时间:2023-08-09 10:34 来源:未知 作者:张德金 点击:次 所属专题: 硫及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、硫
1、“位-构-性”
(1)位置:第三周期VIA族。
(2)结构:

(3)性质:(预测)
①氧化性:最外层能得2电子,反应后显-2价,显示为氧化性。
与金属钠反应:生成Na2S。与金属铝反应:生成Al2S3。
②还原性:自然界中能看到稳定的+6价,+4价也偶尔看到,-2价反而很少见,说明硫具有较强的还原性。
与F2反应:生成SF6。与O2反应:生成SO2。
③氧化性比较:比氯的氧化性差,比氧的氧化性差。【推理】
2、物理性质(先列举各种可能,再一一确认)

颜色:,状态:,密度:,溶解性:。熔沸点,硬度:,导电性:。气味:,毒性:。……
有些性质需要查资料(教材),有些性质需要推理,有些性质需要默认。
【记忆性知识】颜色:黄色,状态:晶体,密度:是水的两倍左右(水溶液中生成时会产生黄色沉淀),溶解性:难溶于水、微溶于酒精、易溶于CS2。
【推理性知识】熔沸点不高,硬度:不大,导电性:不导电。
固体硫由分子构成,分子之间为分子间作用力,所以熔沸点不高,硬度不大。
硫是非金属,也不处于金属与非金属的交界处,固体由分子构成,没有自由移动的离子或电子,所以不能导电。
【默认知识】气味:无,毒性:无。
没有提到的知识,是不具有特殊性的,要按普通化进行类比。这样才能快速做到学少而会多。
3、化学性质(从金属、非金属、氧化物、酸、碱、盐等角度分析)
(1)与金属反应:S显示为氧化性,氧化性不如Cl2和O2,与Fe、Cu生成低价化合物。
Fe+S FeS,2Cu+S
FeS,2Cu+S Cu2S
Cu2S
硫和汞常温下能反应:Hg+S=HgS,可以用硫处理泄露的汞。
(2)与非金属反应:
S若与强氧化性非金属反应,显示为还原性。
S+O2 SO2
SO2
S若与还原性非金属反应,显示为氧化性。
H2+S H2S
H2S
(3)与氧化物反应:
与水在常温或加热时,均不反应。
与强氧化性氧化物SO3、N2O5等反应:
S+2SO3(g) 3SO2
3SO2
(4)与酸反应:
与强氧化性酸反应,显示还原性。
【推理】S+2H2SO4(浓)=3SO2↑+2H2O
【推理】S+6HNO3(浓)= H2SO4+6NO2↑+2H2O(也有SO2生成的可能)
与强还原性酸HI不能反应,原因是S的氧化性不如I2。
(水溶液中粒子的氧化性:MnO4->Cl2>Br2>Fe3+>I2>S)
(5)与热的强碱溶液反应:碱没有氧化性和还原性,S自身氧化还原。
【推理】3S+6NaOH 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
(6)与盐反应:
与强氧化性的盐反应,显示还原性。
S能慢慢溶解到酸性KMnO4溶液(含稀H2SO4)中:
【推理】5S+6KMnO4+4H2SO4=3K2SO4+6MnSO4+4H2O
有时,也能显示氧化性,例如黑火药反应:“一硫二硝三碳”
S+2KNO3+3C K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
二、二氧化硫
1、物理性质
颜色?状态?气味?毒性?溶解性?密度?
除了密度,只能根据生活经验和看教材。
无色、有刺激性气味的有毒气体,易溶于水,1体积的水可以溶解40体积的SO2。
【推理】密度比空气的大。
2、化学性质
(1)SO2是酸性氧化物。
①溶于水后,少量SO2能和水反应生成H2SO3(二元弱酸)
SO2+H2O⇌H2SO3
②与NaOH溶液反应能生成两种盐。
【推理】SO2+2NaOH(过量)=Na2SO3+H2O
SO2+NaOH(少量)=NaHSO3
③CaSO3难溶于水。通入澄清石灰水的现象与CO2相似:
【推理】先产生白色沉淀,后来沉淀慢慢溶解。
先后发生的反应为
SO2+Ca(OH)2=CaSO3↓+H2O
CaSO3↓+H2O+SO2=Ca(HSO3)2
BaSO3也难溶于水。SO2通入Ba(OH)2溶液中的现象也与CO2相似。
(2)SO2的氧化还原能力。
分析SO2中S的价态:+4价,在自然界中不常见,不能稳定存在。旁边有更稳定的+6价,也有较稳定的0价。所以既能显示出强还原性,又能显示出一定的氧化性。
①还原性:
在气体环境中会被O2氧化为SO3。
2SO2+O2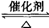 2SO3
2SO3
在水溶液中会被氧化剂氧化为SO42-。
A、SO2与Cl2同时通入水中:
【推理】SO2+Cl2+2H2O=H2SO4+2HCl(Br2、I2也可以)
B、SO2通入酸性KMnO4溶液(含稀H2SO4)中:
【推理】5SO2+2KMnO4+2H2O=K2SO4+2MnsO4+3H2SO4
C、SO2通入H2O2中:
【推理】SO2+H2O2=H2SO4
②氧化性:能与H2S反应
【推理】SO2+2H2S=3S+2H2O
(3)SO2有漂白性
①漂白原理:与某些有色物质生成不稳定的无色物质。
②不是强氧化剂,不是利用强氧化性漂白,与次氯酸、过氧化钠不同。
③漂白结果不稳定,加热时漂白结果容易被破坏,颜色会恢复。

④常用的实验试剂为品红溶液,漂白后变为无色,加热后又变为红色。这种试剂可以检测SO2。
⑤紫色石蕊试液中通入SO2,溶液只变为红色,不褪色。
(4)SO2有杀菌消毒能力
可以用作食品的添加剂。又由于具有强还原性,同时可做抗氧化剂,防止食品的氧化变质。
葡萄酒中添加有SO2。
但SO2有一定的毒性,使用范围和用量有严格限制。
3、可逆反应:
(1)定义:在同一条件下,既能向正方向进行,又能向逆方向进行的反应,叫可逆反应。
(2)已经学过的反应有:
2SO2+O2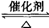 2SO3
2SO3
SO2+H2O⇌H2SO3
CO2+H2O⇌H2CO3
H2+I2 2HI
2HI
(3)可逆反应可以从逆向开始。
2SO3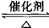 2SO2+O2
2SO2+O2
(4)可逆反应的反应物不能完全反应。
例如,2mol SO2和2mol O2在催化剂和加热的条件下,充分反应,生成的SO3的物质的量小于2mol。
三、三氧化硫和硫酸
1、SO3是酸性氧化物,对应的酸是H2SO4。
(1)SO3遇水完全反应生成H2SO4。
SO3+H2O=H2SO4
(2)SO3与碱性氧化物,碱能反应
SO3+CaO=CaSO4
SO3+2NaOH=Na2SO4+H2O
2、硫酸的工业制取

4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
3、硫酸的性质
(1)纯硫酸
纯净的硫酸在常温下为透明无色油状液体。熔点10.3℃,沸点337℃。与水以任意比互溶。难挥发。
纯硫酸中H2SO4以分子形式存在,分子之间有氢键,不发生电离,液体状态时不导电。
(2)稀硫酸
高中阶段认为在稀硫酸中,H2SO4中两个H完全电离为H+,显示为强酸性。
与活泼金属、碱性氧化物、碱、弱酸盐、可溶性钡盐等发生反应。
(3)浓硫酸
一般指质量分数为98.3%的硫酸水溶液,其密度为1.84g/cm3。
①有吸水性
吸收周围环境中的水分,或将结晶水合物中的结晶水吸收。
可以用作干燥剂。
②有脱水性
将化合物中H和O按2:1的比例脱去。
浓硫酸能将蔗糖、纸张、棉布、木材等脱水。
【实验】蔗糖与浓硫酸的脱水实验

过程中放热,有脱水和氧化,产生大量气体,有刺激性气味,形成黑面包状固体。
分析:脱水过程是C12H22O11 12C+11H2O。为什么会有大量气体产生呢?
12C+11H2O。为什么会有大量气体产生呢?
【推理】有SO2产生,浓硫酸起了氧化作用,同时C被氧化,生成CO2。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
③有强氧化性,能氧化大多数金属和部分非金属。
注意:浓硫酸遇铁、铝有钝化现象,这是化学现象,使金属表面形成致密氧化膜后阻碍了内部金属的反应,导致反应停止。
铜能与热的浓硫酸反应:
【实验】铜与浓硫酸的反应

现象:铜丝上有气泡生成,品红溶液褪色,紫色石蕊溶液变红。将反应后的溶液小心倒入水中,水变为蓝色。这些现象可推理出:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
此反应不能写成离子方程式。浓硫酸中H2SO4绝大多数没有发生电离,反应后的CuSO4主要以固体形式存在于反应体系中。
这个反应说明,浓硫酸的氧化性比稀硫酸(H+)的氧化性强。
【提醒】由于浓硫酸有强氧化性,有些还原性气体不能被浓硫酸干燥:HI、H2S、HBr等。
④有难挥发性
用NaCl和浓硫酸可以制易挥发的氯化氢。
2NaCl+ H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
四、几种硫酸盐,硫酸根离子的检验
1、几种硫酸盐
(1)CaSO4:自然界中常以石膏CaSO4·2H2O形式存在。加热到150℃时会失去大部分结晶水变为熟石膏2CaSO4·H2O。
2CaSO4·2H2O 2CaSO4·H2O+3H2O
2CaSO4·H2O+3H2O
熟石膏与水混合后会很快凝固,变为石膏。
2CaSO4·H2O+3H2O=2CaSO4·2H2O
可以用来制作模型、石膏绷带,可以用于调节水泥的硬化速度。
(2)BaSO4:自然界中以重晶石(BaSO4)的形式存在。不容易溶于水和酸,不易被x射线透过,在医疗上可以用作“钡餐”。
用BaSO4制可溶性的Ba(OH)2、BaCl2、Ba(NO3)2等的方法如下:
先将BaSO4与木炭在一起高温反应制BaS。
BaSO4+4C BaS+4CO↑
BaS+4CO↑
再用BaS与H2O(水解)、HCl等反应。
2BaS+2H2O=H2S↑+Ba(Hs)2
BaS+2HCl=H2S↑+BaCl2
(3)CuSO4:硫酸铜是白色粉末,结合水后会生成蓝色晶体胆矾(CuSO4·5H2O)。可以利用硫酸铜检验酒精中是否含有水。
胆矾和石灰乳混合制成波尔多液,可用作农药。
2、SO42-的检验方法
(1)【实验】向稀硫酸、Na2SO4溶液、Na2CO3溶液中加入少量BaCl2溶液,观察现象。然后再分别加入少量稀盐酸,振荡,观察现象。

SO42-的检验方法:先在溶液中加少量稀盐酸,再加少量BaCl2溶液。若有白色沉淀,则有SO42-。
加盐酸是为了排除CO32-或Ag+等的干扰。
(2)不能因为避开Ag+而将盐酸改为稀硝酸或将BaCl2改为Ba(NO3)2,因为加盐酸和BaCl2还能排除SO32-的干扰。若改为稀硝酸或Ba(NO3)2,SO32-会被氧化为SO42-。
3、粗盐的提纯(实验设计)
粗盐中含有Na2SO4、MgCl2、CaCl2等。如何除去这些杂质?
(除杂的物质加入量是稍过量的)
三个问题:除去这些杂质用什么?过量的杂质怎么办?加入的顺序是否有说法?

加入顺序:先将粗盐溶于水,加入稍过量的BaCl2、NaOH、Na2CO3(保证Na2CO3在BaCl2之后加入即可),充分反应后过滤、洗涤,再在滤液中加稍过量的稀盐酸,蒸发滤液得到晶体即可。
五、不同价态含硫物质的转化
1、自然界中不同价态的硫的存在形态、位置、转化

自然界中不同价态的硫的转化:

2、不同价态含硫物质的价类二维图

3、实验室中不同价态含硫物质的转化:
(1)几个规则:
①在实验室环境中,硫的+6价最稳定,其次是0价。但在岩层深处,-2价最稳定。
②-2一般被氧化为0。氧气过量的气态体系中可能被氧化为+4(SO2)。
③溶液中:0、+2、+4一般被强氧化剂氧化为+6。
④歧化反应一般生成两侧相邻价态,归中反应生成中间价态。
⑤同种元素的同种价态有相似的氧化还原能力。
⑥中间价态的既有氧化性,又有还原性。最高价的只有氧化性,最低价的只有还原性。
⑦环境对氧化还原能力有影响。环境指溶液的酸碱性或空气中的氧气的氧化氛围等。
(2)不同价态的硫及对应的常见物质及反应(所有反应采用【推理】)

①H2S溶液、Na2S溶液、NaHS溶液都能被氯气氧化。
H2S+Cl2=S↓+2HCl
Na2S+Cl2=S↓+2NaCl
NaHS+Cl2=S↓+NaCl+HCl
②H2S可燃,氧气不足时生成S,氧气充足时生成SO2。
2H2S+O2 2S+2H2O
2S+2H2O
2H2S+3O2 2SO2+2H2O
2SO2+2H2O
③热的Na2SO3溶液与S能反应。
Na2SO3+S Na2S2O3
Na2S2O3
Na2S2O3溶液中加入盐酸有浑浊出现,有刺激性气味气体生成。
Na2S2O3+2HCl=S↓+SO2↑+2NaCl+H2O(提示:HCl无明显氧化还原能力)
Na2S2O3溶液中通入氯气能反应。
Na2S2O3+4Cl2+5H2O= Na2SO4+H2SO4+8HCl
④Na2SO3溶液敞口放置在空气中,易被氧化。
2Na2SO3+O2=2Na2SO4
Na2S溶液敞口放置在空气中,易被氧化,现象是出现浑浊。
2Na2S(aq)+O2+2H2O=2S↓+4NaOH
这些溶液及对应的固体都要密封保存。
⑤Na2S溶液中通入SO2有浑浊出现。
2Na2S+3SO2=3S↓+2Na2SO3
Na2S与Na2SO3的混合溶液中滴入盐酸有浑浊出现。
2Na2S+Na2SO3+6HCl=3S↓+6NaCl+3H2O
⑥Na2SO3遇到稀盐酸和稀硝酸的不同
Na2SO3+2HCl=2NaCl+SO2↑+H2O
3Na2SO3+2HNO3=3Na2SO4+2NO↑+H2O
4、化学实验设计
(1)什么是化学实验设计:
实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器、步骤和方法等所进行的规划。
(2)化学实验设计的几个原则:
科学性、可行性、安全性、绿色化原则。
(3)化学实验设计方案包括:
实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。

- 全部评论(0)
