氮及其化合物性质知识点总结
时间:2023-08-13 19:58 来源:未知 作者:化学自习室 点击:次 所属专题: 氮及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氮气
(一)氮气的性质和应用
1、原子结构
(1)原子结构示意图:

(2)在周期表中位置:第二周期第Va族
(3)原子的轨道表示式:
 ,
,
单电子数:3
(4)第一电离能:

2、氮气的结构
(1)结构式N≡N,
电子式


(2)分子极性:非极性分子
3、氮元素的自然存在

4、自然界中氮的循环

5、氮气的用途:
合成氨;制硝酸;用作保护气;保存农副产品;液氮可作冷冻剂。
(二)氮气的性质
1、物理性质
(1)色味态:无色无味气体
(2)密度:在标准状况下

比空气的小(极为接近)
(3)溶解性:难溶于水
(4)收集方法:只能用排水法(密度与空气接近,不能用排空气法)
2、化学性质
(1)稳定性:N≡n(键能很大),通常情况下很难发生反应
(2)氧化性:

(工业固氮反应)
(3)还原性
①除去中H2的N2:

②高能固氮反应:

3、氮化镁

二、氮的氧化物
(一)氮的氧化物的性质及应用
1、氮元素的六种氧化物

(1)N2O俗称笑气。
(2)N2O3、N2O5是HNO2、HNO3相应的酸性氧化物(或酸酐)。
(3)NO2与N2O4可相互转化2NO2⇆N2O4。
2、NO的性质
(1)色味态:无色无味气体
(2)溶解性:难溶于水
(3)强还原性

3、NO2的性质
(1)色味态:红棕色有刺激性气味气体
(2)溶解性:易溶于水,不溶于四氯化碳
(3)与H2O反应:

(4)双聚反应:

①加热:红棕色变深
②加压:颜色先变深后变浅,比加压前深
(5)强氧化性:能够将某些还原性微粒氧化,自身被还原成NO


(6)鉴别NO2和溴蒸气

4、氮氧化物的危害
(1)形成硝酸型酸雨
含氮物质
(2)形成光化学烟雾
 有毒烟雾
有毒烟雾
(3)破坏臭氧层:NO催化O3分解为O2

(4)水体富营养化:水中含氮化合物引起水体污染
5、常见的处理氮氧化物的方法
(1)NaOH溶液吸收法

(2)纯碱溶液吸收法

(3)CH4还原法

(4)NH3还原法

(5)H2还原法

(6)CO还原法

(二)实验室制一氧化氮和二氧化氮
1、反应原理及装置
(1)装置类型:“固体+液体气体”型

(2)药品:铜和稀(浓)硝酸
(3)反应

2、气体的净化:
一般用无水氯化钙或P2O5或硅胶除水蒸气
3、气体的收集
(1)NO:只能用排水法收集或排“惰性”气体法

(2)NO2:向上排空气法或排四氯化碳法
4、气体的检验
(1)NO:通入空气,无色气体变成红棕色气体
(2)NO2:通过湿润的淀粉碘化钾试纸变蓝
5、尾气吸收
(1)NO:一般用酸性的H2O2、酸性高锰酸钾溶液等强氧化性溶液吸收
(2)NO2:一般用NaOH、Na2CO3等碱性溶液吸收
6、制NO前,先通氮气、二氧化碳等气体将装置内的空气排尽
三、氨气
(一)氨气的性质
1、物理性质
(1)色味态:无色、有刺激性气味的气体
(2)密度:比空气的小
(3)溶解性:极易溶于水,1∶700,难溶于CCl4
(4)物理特性:易液化(沸点-33.5℃)
2、碱性气体
(1)水:

(2)指示剂:能够使紫色石蕊试液变蓝,酚酞试液变红
(3)与酸化合成铵盐

3、氨气的还原性:
![]()
(1)催化氧化:
![]()
(2)热的CuO:
![]()
(3)还原氯气
①少量NH3:
![]()
②过量NH3:

(检验输送氯气的管道是否泄漏)
4、氧化性:

5、氨气的用途
(1)制硝酸和硝酸铵:

(2)致冷剂:液氨气化吸热,使环境温度急剧降低
(3)制化肥:制备硝铵、硫铵、氯铵、碳铵等铵态氮肥
(二)实验室制取氨气
1、反应原理及装置
(1)装置类型:


①方法:氯化铵固体与氢氧化钙固体混合加热
②反应:
![]()
(2)装置类型:


①方法:加热浓氨水
②反应:
![]()
(3)装置类型:
![]()


2、气体的净化:一般用碱石灰吸水
3、气体的收集
(1)方法:向上排空气法和排四氯化碳液体法
(2)净化:试管口堵棉花的作用:防止氨气和空气发生对流,提高氨气的收集速率和纯度
4、验满方法
(1)最佳方法:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则说明氨气收集满了
(2)其他方法:用玻璃棒蘸取浓盐酸或浓硝酸放在集气瓶口,若产生白烟,则说明氨气收集满了
5、尾气吸收
(1)吸收剂:棉花最好用稀硫酸浸湿,防止污染空气
(2)注意防倒吸

6、氨气的工业制法:
工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气

7、喷泉实验的原理及操作
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
(2)能形成喷泉的条件
从原理上讲,气体要易溶于水或易与水反应,以形成足够大的压强差;从实验条件上讲,烧瓶内气体要充满,气体和仪器均要干燥,装置的气密性要好。
(3)形成喷泉的气体与液体组合
①极易溶于水的气体(NH3、HCl等)与水可形成喷泉;
②酸性气体与NaOH溶液组合能形成喷泉。

(4)喷泉实验成功的关键
①盛气体的烧瓶必须干燥;
②气体要充满烧瓶;
③装置不能漏气(实验前应先检查装置的气密性);
④所用气体能大量溶于所用液体或气体与液体能快速反应。
(5)常见的喷泉实验装置
喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来产生喷泉。

装置Ⅰ:打开止水夹,挤压胶头滴管的胶头,使少量水进入烧瓶,导致大量的NH3溶解。烧瓶内形成负压而产生喷泉。
装置Ⅱ:挤压气球,即可使少量的溶液沿导管进入烧瓶,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅲ:去掉了胶头滴管。打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)
装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:向烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液 喷到烧瓶内。
喷到烧瓶内。
(三)氨的催化氧化实验
1、反应原理:

2、氨气的提供
(1)浓氨水
①向浓氨水中通入空气,使氨挥发出来,从而使氧气和氨充分混合。
②向浓氨水中加入Na2O2,使浓氨水分解产生氨气,从而使氧气和氨充分混合。
(2)铵盐分解法提供氨气
3、氧气的提供
(1)直接通入空气法
(2)双氧水在二氧化锰的催化作用下分解:
![]()
(3)过氧化钠和水反应:
![]()
(4)氯酸钾和二氧化锰混合加热:
![]()
(5)高锰酸钾固体加热:
![]()
(6)过氧化钠和碳酸(氢)铵混合加热:

4、实验现象
(1)锥形瓶中气体呈红棕色:这是因为NH3被氧化为NO,NO遇到空气中的O2又迅速被氧化为红棕色的NO2。
(2)通常瓶内有白烟出现:这是由于锥形瓶里有水蒸气存在,水蒸气和NO2反应生成了HNO3:3NO2+H2O=2HNO3+NO,HNO3再跟NH3反应生成微小的白色NH4NO3晶体:NH3+HNO3=NH4NO3。
(3)铂丝呈红色:这是因为NH3与O2在铂丝的表面上进行的反应是放热反应,反应放出的热量足以使铂丝继续保持红热状态。
(四)氨水的性质
1、氨水的密度
(1)比水小,浓度越大,密度越小
(2)质量分数为a和b的两种氨水混合
①等质量混合,所得氨水的质量分数
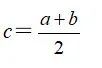
②等体积混合,所得氨水的质量分数
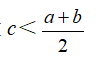
2、氨水的挥发性:易挥发出氨气,所以氨水应密封保存
3、氨水的组成
(1)三个可逆反应
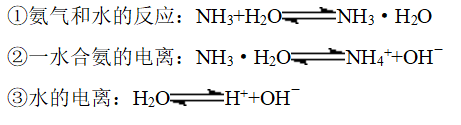
(2)“三分子”、“三离子”成分
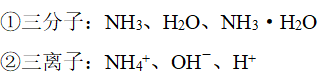
4、氨水的化学性质
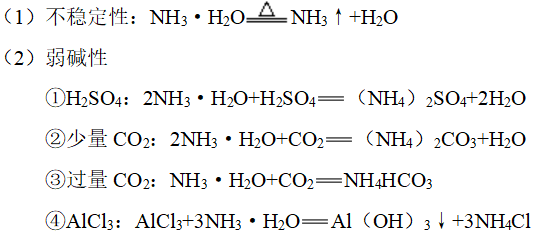
五、铵盐的结构和性质
1、物理性质:都是无色,易溶于水的晶体
2、结构:NH4+的电子式
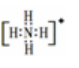
(1)所含化学键:离子键、共价键和配位键
(2)化合物类型:离子化合物
3、热不稳定性
(1)非氧化性酸铵盐氨气和相应的酸
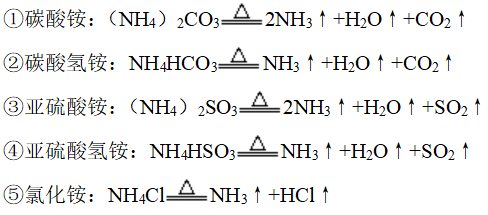
(2)氧化性酸铵盐复杂的氧化还原反应,一般不放氨气
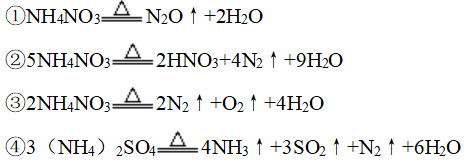
4、铵盐和碱反应
(1)条件不同,产物不同
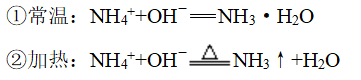
(2)注意事项
①铵态氮肥不能与碱性物质混合使用,以免生成氨气,降低肥效。
②铵盐固体和碱固体反应时,不能拆写成离子形式
③酸式铵盐和碱溶液反应时,注意碱过量时,NH4+和酸式酸根离子都参与反应
5、铵盐的检验
(1)步骤:取样,加碱,加热,加湿润的红色石蕊试纸
(2)现象:湿润的红色石蕊试纸变蓝
六、硝酸的性质
1、物理性质
(1)色味态:纯硝酸是一种无色有刺激性气味的液体
(2)密度:比水的大,密度越大,浓度越越大,常见浓硝酸浓度为68%~70%
(3)溶解性:以任意比和水互溶
①主要原因:硝酸和水之间可以形成氢键
②次要原因:硝酸和水都是极性分子
(4)挥发性:易挥发,浓度为95%以上的硝酸称为发烟硝酸
2、不稳定性
(1)反应:
![]()
(2)通常所见的浓硝酸因含NO2而呈黄色
①除去黄色最简单的方法:加水
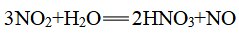
②除去黄色最环保的方法:通足量氧气
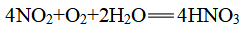
3、与金属单质反应
(1)
![]()
(2)Au、Pt:任何情况下都不反应
(3)其他金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同
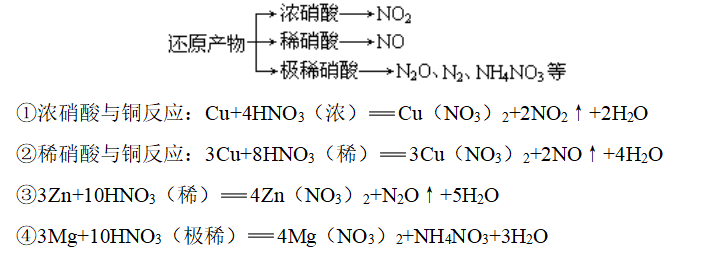
(4)
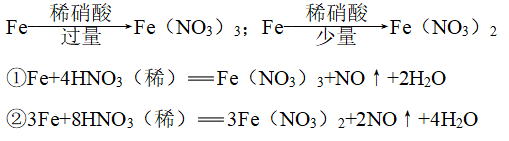
4、浓硝酸与非金属单质加热反应
(1)碳与浓硝酸加热反应:
![]()
(2)碳与稀硝酸不反应
5、
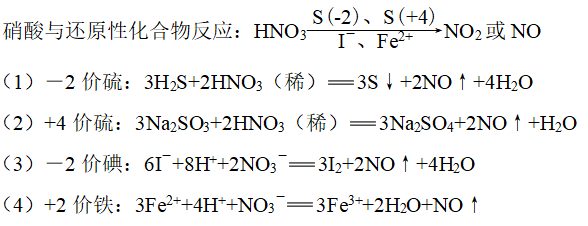
6、几种物质和湿润的蓝色石蕊试纸的反应

7、浓硝酸的保存
(1)易挥发:密封保存,敞口放置,质量减小,浓度降低
(2)易分解:棕色细口瓶避光、黑暗而且温度低的地方
(3)强氧化性:不能用橡胶塞,而用玻璃塞
(4)大量存放:铝制或铁制的槽车内
8、硝化反应
(1)苯:
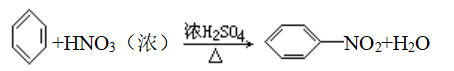
(2)甲苯:制备黄色的TNT炸药

(3)颜色反应:含苯环的蛋白质遇到浓硝酸显黄色

- 全部评论(0)
