利用“线网殊”学习氮及其化合物
时间:2016-01-21 12:20 来源: 作者:姚小伟 点击:次 所属专题: 氮及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、线
学习元素化合物知识,要运用“结构—性质—制法—用途”这种由点联线的方法。在学习氮及其化合物时,要抓住硝酸和铵盐的工业生产这条主线:
![]()
它包含着一条明线:即![]() 。它通过化合价变化分析物质的氧化性、还原性,从而掌握其相互间的歧化、归中及互变关系;另一条为暗线:氧气参加反应是该部分知识的暗线,它不仅涉及物质间的转化关系,而且是设计计算题的原材料。
。它通过化合价变化分析物质的氧化性、还原性,从而掌握其相互间的歧化、归中及互变关系;另一条为暗线:氧气参加反应是该部分知识的暗线,它不仅涉及物质间的转化关系,而且是设计计算题的原材料。
例如明线中的歧化反应和归中反应:
歧化反应:
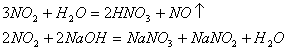
归中反应:
![]()
例如暗线中有氧参加的反应:
![]()
二、网
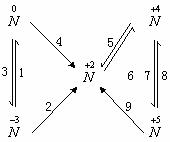
氮及其化合物间的相互关系可用一特殊的双三角网表示。实现双三角中各步转化的化学方程式及知识的拓展如下:
(1)![]() 氨在纯氧中燃烧:
氨在纯氧中燃烧:
![]() ;
;
氨被氯气氧化:
![]() 或
或![]()
拓展:氨具有还原性,实验室可用铵盐和亚硝酸钠反应制取![]() 。
。
(2)![]() 氨的催化氧化:
氨的催化氧化:
![]()
拓展:NO具有较高的热稳定性,但极易被氧化成NO2。
(3)![]() 工业合成氨的反应:
工业合成氨的反应:
![]()
![]()
![]() ;
;
镁在N2中燃烧:
![]()
(4)![]() 放电条件下N2和O2的直接化合:
放电条件下N2和O2的直接化合:
![]()
拓展:N2很稳定,与其他物质反应时,需苛刻的条件。
(5)![]() 一氧化氮的氧化:
一氧化氮的氧化:
![]()
拓展:收集NO不能用排空气法。
(6)![]() 二氧化氮与二氧化硫间的反应:
二氧化氮与二氧化硫间的反应:
![]()
拓展:NO2具有强氧化性,能使湿润的KI—淀粉试纸变蓝。
(7)![]() 二氧化氮与水的歧化反应:
二氧化氮与水的歧化反应:
![]() ;
;
![]() ;
;
![]()
拓展:收集NO2不能用排水法,通常情况下收集到的NO2不可能是纯净物。当NO2与O2按4:1的体积比混合,NO和O2按4:3的体积比混合后能被水完全吸收。
(8)![]()
![]() ;
;
![]() ;
;
![]()
拓展:硝酸具有强氧化性,浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO。
三、殊
(1)氮元素的非金属性仅次于氟和氧。氮气性质不活泼是因为两个氮原子之间以键能为946kJ·mol-1的三键结合,是所有双原子分子中键能最大的。因而尽管氮是十分活泼的非金属,但自然界仍有大量的游离态的氮气存在。
(2)氨水中的氨主要以![]() 的形式存在,但计算氨水的物质的量浓度时,则应以氨分子为溶质(其摩尔质量为17g·mol-1)。
的形式存在,但计算氨水的物质的量浓度时,则应以氨分子为溶质(其摩尔质量为17g·mol-1)。
(3)硝酸除具有酸的通性外,应特别注意它的强氧化性。在与金属反应时,生成的气体是氮氧化物NOx,而不是H2。
(4)氮元素有五种正价(+1、+2、+3、+4、+5),但有六种氮的氧化物(![]()
![]() )。
)。
(5)常温下,将铁、铝、铬等金属投入浓硝酸中,会发生钝化现象。钝化是浓硝酸的强氧化性使金属表面形成一层致密的氧化膜,阻止反应进一步进行。而氧化膜的产生,本身就是化学反应,所以并非不发生化学反应。
(6)通常溶液的浓度越大,密度越大,但氨水的浓度越大,其密度反而越小。
(7)通常碱性气体可选择中性干燥剂干燥,但氨气不能选用![]() 干燥,这是因为
干燥,这是因为![]() 与
与![]() 发生反应生成
发生反应生成![]() 。
。

- 全部评论(0)
