二氧化硫三大实验考点总结
时间:2023-08-14 09:55 来源:未知 作者:化学自习室 点击:次 所属专题: 二氧化硫
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、二氧化硫的实验室制备
1、实验原理:

2、实验装置:

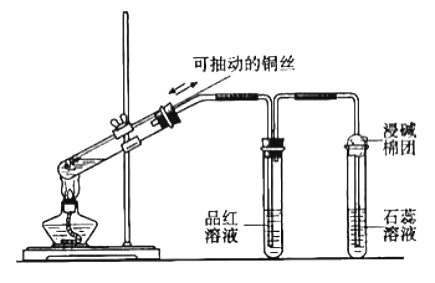
(1)发生装置:
①用分液漏斗、圆底烧瓶组装的固液加热型制气装置
②铜(可抽动铜丝,可随时控制反应发生和停止)与浓硫酸加热
(2)净化装置:盛有浓硫酸的试管,干燥除水蒸气
(3)收集方法:向上排空气法或排饱和亚硫酸氢钠溶液法
(4)尾气处理装置:用强碱溶液吸收多于二氧化硫,防止污染空气
3、性质检验:
(1)漂白性:先通入品红试液,褪色,加热后又恢复原红色
(2)还原性:
①将气体通入稀氯水中,使氯水褪色;
②将气体通入稀溴水中,使溴水褪色;
③将气体通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色;
④将气体通入氯化铁溶液中,氯化铁溶液由黄色变成浅绿色;
⑤将气体通入硝酸钡溶液中,产生沉淀。
(3)氧化性:通入氢硫酸,发生归中反应,产生黄色S沉淀
4、验满方法:
用玻璃棒蘸氨水放在瓶口,如果出现浓厚的白烟,表示二氧化硫已收集满。
5、实验相关考点:
(1)由于二氧化硫极易溶于水,所以实验室制取二氧化硫的过程中,应用浓硫酸和固体Na2SO4作为反应物,减少二氧化硫的溶解损耗。(浓硫酸浓度为75-85%,不可过浓过稀)
(2)不可用浓盐酸代替浓硫酸,因为其中含有大量的水(常温常压下,质量分数最大的浓盐酸为45%的浓盐酸),否则会有大量的SO2溶解在水中,使产量减少。
(3)实验结束后应先排净装置中残留的二氧化硫,再拆除装置,防止残留的二氧化硫进入到空气中,造成污染。
二、二氧化硫的漂白性检验
1.实验操作及现象
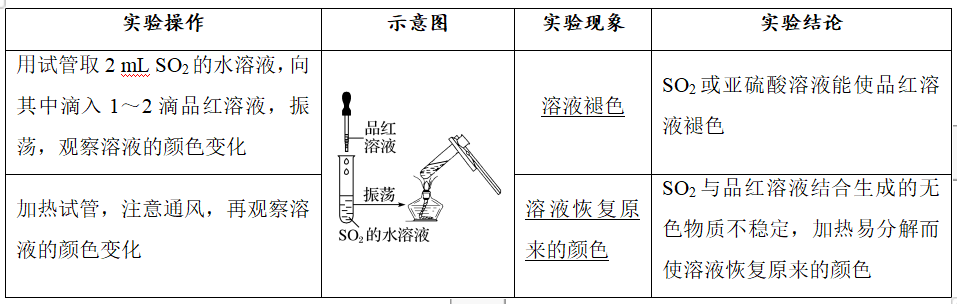
2.实验相关考点
1)SO2的漂白原理:二氧化硫具有漂白作用,能使品红溶液等有色物质褪色。其作用机理是二氧化硫与某些有色物质结合生成了不稳定的无色物质。加热后又显红色,是由于不稳定的无色物质又分解为原来物质的缘故。利用品红溶液可检验SO2气体
2)应用:SO2在工业上应用于漂白纸浆、毛、丝等;此外SO2可用于杀菌消毒,还是一种食品添加剂
3)SO2虽具有漂白性,但不能漂白指示剂,如:SO2通入紫色的石蕊试液中,溶液只变红不褪色,而氧化类漂白剂(氯水、Na2O2)则能漂白酸碱指示剂
4)SO2使溴水、KMnO4溶液褪色,是利用SO2的还原性,而不是漂白性
5)SO2使品红溶液褪色需要一定时间才能观察到明显现象,可以加一份空白品红溶液作对比,以便于观察比较。
3.常见漂白剂的漂白机理
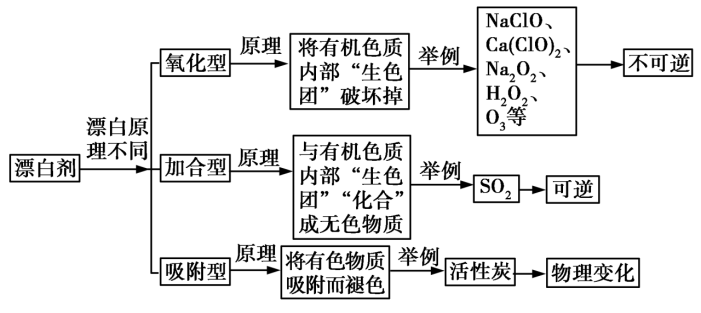
注:只有使有机溶剂的褪色才可称为漂白性。
三、SO2、CO2共同存在时,二者的检验装置的设计过程
1.实验操作及现象

2.实验相关考点
1)有时为简化装置,可将除去SO2(B)和检验SO2是否除尽(C)合并为一个装置,用较浓的酸性KMnO4溶液,现象是酸性KMnO4溶液颜色变浅
2)当SO2中混有CO2时,不会影响SO2的检验;当CO2中混有SO2时会干扰CO2的检验,应先检验并除去SO2,再用澄清石灰水检验CO2气体

- 全部评论(0)
