教材分析(物质结构与性质):原子结构
时间:2023-09-04 15:12 来源:未知 作者:张德金 点击:次 所属专题: 原子结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
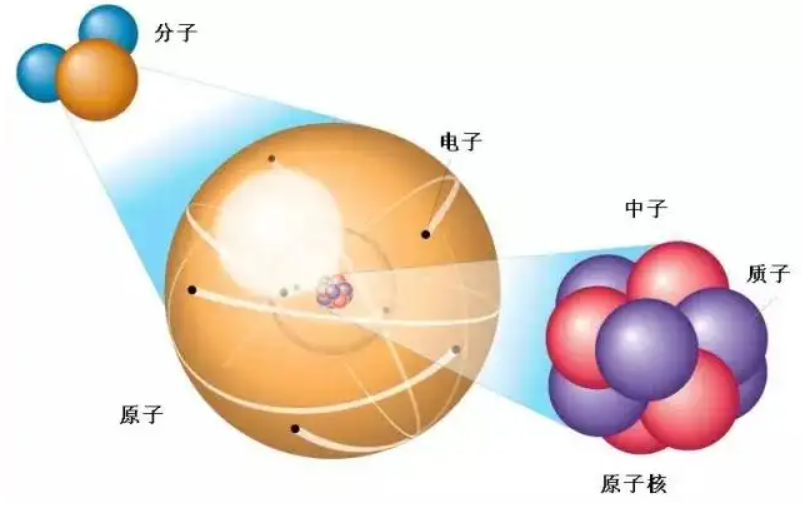
一、能层与能级
1、核外电子的分层
核外电子在能量不同的区域内运动,简化为电子层,又叫能层。能层越高,电子的能量越高。
能层 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
符号 | K | L | M | N | O | P | Q |
最多电子数 | 2 | 8 | 18 | 32 | 50 | 72 | 98 |
不同能层的能量高低顺序为:E(K)< E(L)< E(M)< E(N) < E(O)< E(P)< E(Q)。
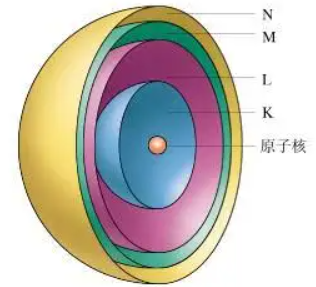
2、同一能层电子的分级
同一能层的电子,还被分成不同的能级,能级的符号为s、p、d、f……。能级越高,电子的能量越高。
能级符号 | s | p | d | f |
最多电子数 | 2 | 6 | 10 | 14 |
能级所容纳的最多电子数依次为自然数中奇数序列1、3、5、7……的2倍。
同一能层中能级的能量高低顺序为:E(s)< E(p)< E(d)< E(f)。
根据能层容纳的最多电子数,可以推理出能层对应的能级数:
| 能层 | 一 | 二 | 三 | 四 | ||||||
符号 | K | L | M | N | ||||||
能层电子数 | 2 | 8 | 18 | 32 | ||||||
能级 | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
能级电子数 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 |
每一能层的能级都是从s能级开始。字母前的数字为能级所在的能层序数。
二、基态与激发态原子光谱
1、基态与激发态
原子处于最低能量状态的原子叫基态。
基态原子吸收能量,它的电子会跃迁到较高的能级,变为激发态原子。
激发态原子,也能电子跃迁到较低的能级,释放能量,变成基态原子或较低能量激发态原子。
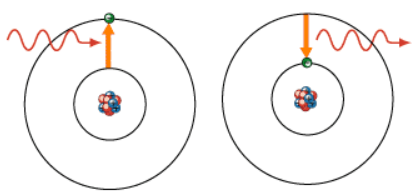
在日常生活中,许多可见光,都和原子核外电子跃迁释放能量有关。如焰火、灯光、激光、LED灯光……
2、原子光谱
原子光谱包括原子吸收光谱和原子发射光谱。
原子在连续光谱的照射下,电子吸收一定频率的能量,从低能量能级跃迁到高能量能级,会形成原子吸收光谱。
原子的电子跃迁到高能量能级后,会从高能量能级跃迁到低能量能级,以光的形式释放出能量,会形成原子发射光谱。

三、构造原理和电子排布式
1、构造原理
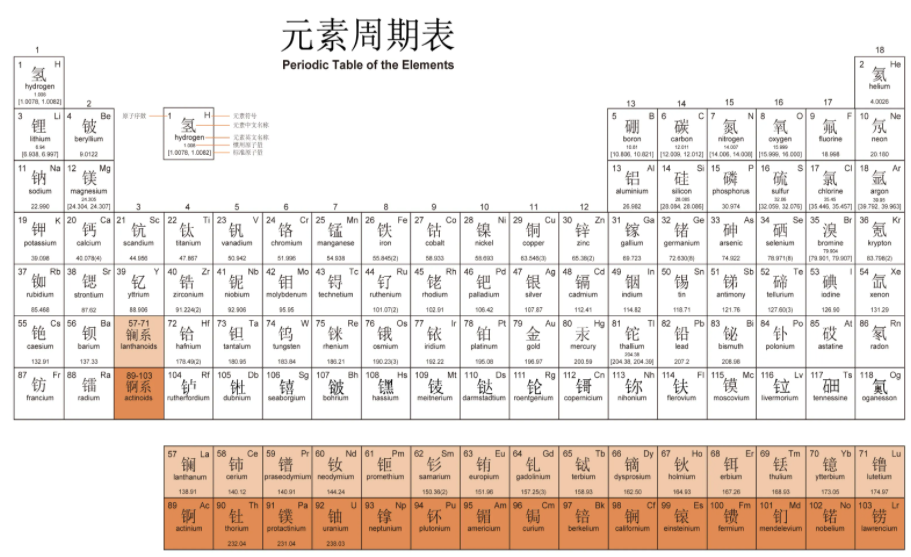
研究元素周期表,你会发现:
第一周期:有2个元素。这正好是第一能层1s能级填满2个电子需要的元素种数。
第二周期:左边有2个元素,右边有6个元素。这正好是第二能层2s能级和2p能级分别填满2个电子和6个电子需要的元素种数。
第三周期:左边有2个元素,右边有6个元素。这正好是第三能层3s能级和3p能级分别填满2个电子和6个电子需要的元素种数。
第四周期:左边有2个元素,中间有10个元素,右边有6个元素。这正好是第四能层4s能级、第三能层3d能级、第四能层4p能级分别填满2个电子、10个电子和6个电子需要的元素种数。
第五周期:左边有2个元素,中间有10个元素,右边有6个元素。这正好是第五能层5s能级、第四能层4d能级、第五能层5p能级分别填满2个电子、10个电子和6个电子需要的元素种数。
第六周期:左边有2个元素,然后镧系元素,然后有9个元素,右边有6个元素。这正好是第六能层6s能级、第四能层4f能级、第五能层5d能级、第六能层6p能级分别填满2个电子、14个电子、10个电子和6个电子需要的元素种数。
第七周期:左边有2个元素,然后锕系元素,然后有9个元素,右边有6个元素。这正好是第七能层7s能级、第五能层5f能级、第六能层6d能级、第七能层7p能级分别填满2个电子、14个电子、10个电子和6个电子需要的元素种数。
从中会得到核外电子的填充规律,电子按能级依次填充1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p,我们把这个填充顺序叫构造原理。

2、电子排布式
根据构造原理,就可以得到用能级描绘核外电子排布状态的电子排布式(基态原子)。
例如
碳C:1s22s22p2。
能级符号的右上角表示的是该能级的电子数。
钠Na:1s22s22p63s1。
硫S:1s22s22p63s23p4。
钪21Sc:1s22s22p63s23p63d14s2。
铁26Fe:1s22s22p63s23p63d64s2。
在书写电子排布式时,一般是能层低的要写在左边,而不是按构造原理的顺序写。
注意:
(1)24Cr和29Cu的最后两个能级的电子排布分别是3d54s1和3d104s1,而不是3d44s2和3d94s2。
(2)简化电子排布式:将前面与上一稀有气体的电子排布式相同的部分,简写为[X](X表示稀有气体符号),所得到的电子排布式,叫简化电子排布式。
例如
钠Na:1s22s22p63s1,简化电子排布式为[Ne] 3s1。
钪21Sc:1s22s22p63s23p63d14s2,简化电子排布式为[Ar]3d14s2。
(3)价层电子排布:在简化电子排布式的基础上,去掉[X]后的排布式。
钠Na:3s1。
钪21Sc: 3d14s2。
四、电子云与原子轨道
1、电子云
电子云是核外电子在核外空间出现的概率密度分布,像一片云雾,称作电子云。
电子云轮廓图用来表示电子云的轮廓形状,包括电子在原子核外空间出现概率90%的区域。常用线条图或立体图两种画法,如s能级的电子云是球形的,轮廓图如下:
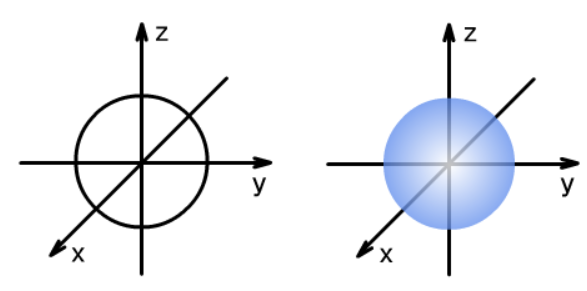
p能级的电子云轮廓图是哑铃形的,而且有3个相互垂直的电子云,分别称为px、py、pz。

d能级的电子云轮廓图有5种,分别称为dxy、dyz、dxz、dx2-y2、dz2。
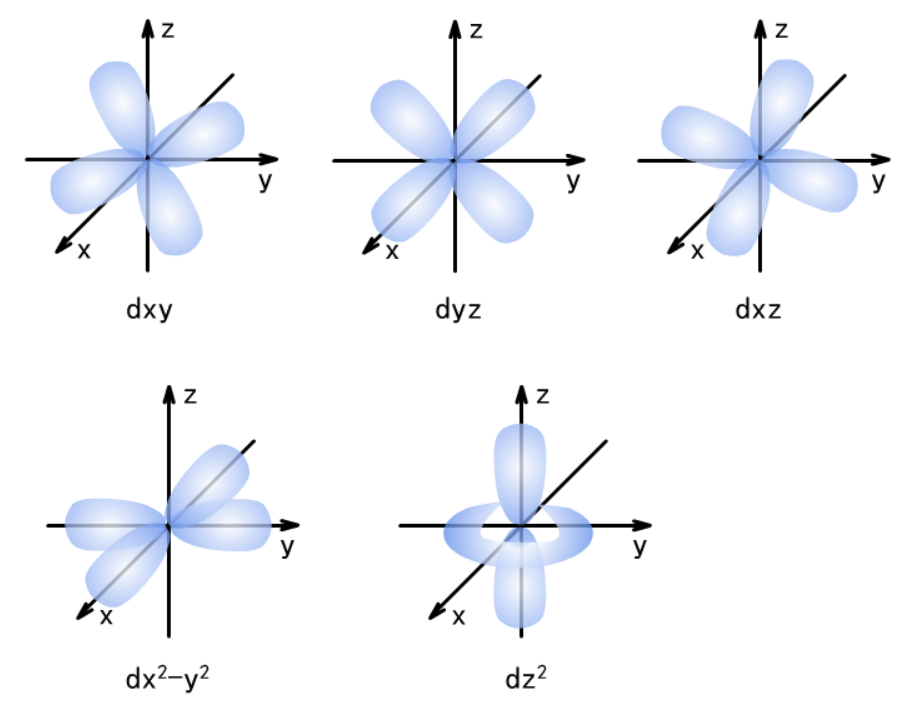
电子在原子核外的一个空间运动状态称为一个原子轨道。
| 能级 | s | p | d | f |
轨道数 | 1 | 3 | 5 | 7 |
以第三能层为例,它的原子轨道有:
3s,3px、3py、3pz,3dxy、3dyz、3dxz、3dx2-y2、3dz2。
1、泡利原理:
自旋:电子除了空间运动状态外,还有一种状态叫自旋。电子的自旋有顺时针和逆时针两种取向,常用“↑”和“↓”表示。
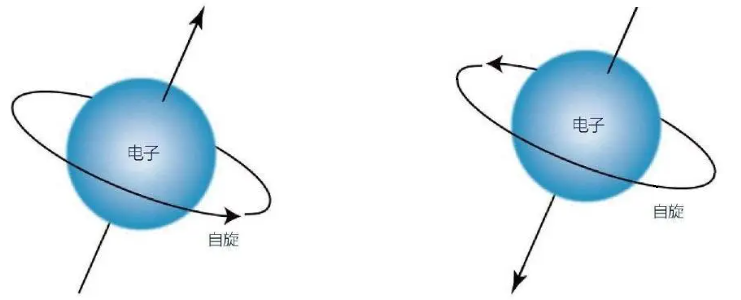
泡利原理:在一个原子轨道里,最多能容纳2个电子,并且它们的自旋相反。
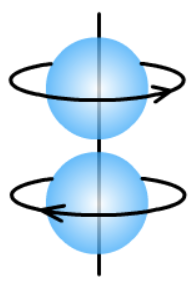
2、洪特规则
洪特规则:基态原子中,填入简并轨道(相同能级的不同轨道)的电子总是先单独分占,且自旋平行。
例如,N原子(1s22s22p3)的2p能级上有3个轨道,有3个电子,这3个电子分别填充3个轨道且自旋方向相同。

3、电子排布的轨道表示式
轨道表示式(又称电子排布图)是表述电子排布的一种图式。
它综合了泡利原理和洪特规则。
比如氧的基态原子的轨道表示式如下:
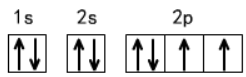
4、能量最低原理
基态是能量最低的状态,基态原子的电子排布是能量最低的原子轨道组合。
在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
当相邻能级能量相差很大时,电子填入能量低的能级使整个原子的能量最低。像所有主族元素的基态原子,如K:[Ar]4s1,S:[Ne]3s23p4。
当相邻能级能量差别不大时,有1-2个电子占据能量较高能级可能反而降低了电子排斥能而使整个原子的能量最低。像所有副族元素的基态原子,如V:[Ar]3d34s2,Cu:[Ar]3d104s1。

- 全部评论(0)
