2023年华侨、港澳、台联考高考化学试卷
时间:2023-12-05 20:33 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共15小题,每小题4分,共60分,在每小题给出的四个选项中,只有一项是符合题目要求的。
【2023港澳台高考】1.(4分)下列试剂与标签不对应的是( )
A.四氯化碳 | B.冰醋酸 | C.高锰酸钾 | D.丁烷 |
| | | |
A.A B.B C.C D.D
【解答】解:A. 表示易燃液体,四氯化碳不能燃烧,故A错误;
表示易燃液体,四氯化碳不能燃烧,故A错误;
B. 表示腐蚀品,冰醋酸具有酸性,具有腐蚀性,故B正确;
表示腐蚀品,冰醋酸具有酸性,具有腐蚀性,故B正确;
C. 表示氧化剂,高锰酸钾具有强氧化性,表示正确,故C正确;
表示氧化剂,高锰酸钾具有强氧化性,表示正确,故C正确;
D. 表示易燃气体,丁烷是易燃气体,表示正确,故D正确;
表示易燃气体,丁烷是易燃气体,表示正确,故D正确;
故选:A。
【2023港澳台高考】2.(4分)下列消毒剂不是利用其氧化性进行消毒的是( )
A.0.5%过氧乙酸溶液
B.1%次氯酸钠溶液
C.75%乙醇溶液
D.3%双氧水溶液
【解答】解:A.0.5%过氧乙酸溶液具有强氧化性,利用其氧化性进行消毒,故A正确;
B.1%次氯酸钠溶液有强氧化性,利用其氧化性进行消毒,故B正确;
C.75%乙醇溶液,是通过透过细菌表面脱水而使蛋白质变性,不是利用其氧化性消毒,故C错误;
D.3%双氧水溶液有强氧化性,利用其氧化性进行消毒,故D正确;
故选:C。
【2023港澳台高考】3.(4分)下列物质水解能生成果糖的是( )
A.淀粉 B.纤维素 C.蔗糖 D.麦芽糖
【解答】解:A.淀粉水解产物为葡萄糖,没有产生果糖,故A错误;
B.纤维素水解产物是葡萄糖,没有产生果糖,故B错误;
C.蔗糖是二糖,水解产物为果糖和葡萄糖,产生果糖,故C正确;
D.麦芽糖是二糖,水解产物为葡萄糖,没有产生果糖,故D错误;
故选:C。
4.(4分)下列属于非极性分子的是( )
A.对二甲苯 B.苯甲酸 C.对硝基甲苯 D.苯甲醚
【解答】解:A.对二甲苯为对称结构,正负电荷重心重合,为非极性分子,故A正确;
B.苯甲酸含有极性键,分子不是对称结构,正负电荷的中心不重合,为极性分子,故B错误;
C.对硝基甲苯分子正负电荷中心不重合,是极性分子,故C错误;
D.苯甲醚中含有极性键,分子结构不对称,正负电荷的中心不重合,为极性分子,故D错误;
故选:A。
【2023港澳台高考】5.(4分)工业制乙炔的反应为CaC2+2H2O═C2H2↑+Ca(OH)2,下列说法错误的是( )
A.CaC2为离子化合物
B.Ca2+的结构示意图为
C.C2H2含有极性和非极性共价键
D.H2O的电子式为:
【解答】解:A.碳化钙为离子化合物,由钙离子与 离子构成,故A正确;
离子构成,故A正确;
B.Ca2+离子核外电子数为18,核电荷数为20,由里到外各层电子数依次为2、8、8,Ca2+的结构示意图为 ,故B正确;
,故B正确;
C.C2H2的结构式为HC≡CH,C﹣H是极性共价键,C﹣C是非极性共价键,故C正确;
D.O中存在孤电子对,水的电子式为: ,故D错误;
,故D错误;
故选:D。
【2023港澳台高考】6.(4分)关于HF+OD﹣═F﹣+HOD(D为氘),下列说法正确的是( )
A.HOD与H2O的质量数相同
B.HF和DF为同分异构体
C.H和D的电子数相同
D.OD﹣和OH﹣的中子数相同
【解答】解:A.HOD的质量数为19,H2O的质量数为18,质量数不相同,故A错误;
B.HF和DF都是化合物,不是同分异构体,故B错误;
C.H和D的电子数均为1,电子数相同,故C正确;
D.OD﹣的中子数为9,OH﹣的中子数为8,中子数不同,故D错误;
故选:C。
【2023港澳台高考】7.(4分)向X溶液加入等体积的Y溶液后,导电性显著增加且酸碱性显著改变的是( )
X(0.01mol•L﹣1) | Y(0.01mol•L﹣1) | |
A. | Na2CO3 | HAc |
B. | Na2SO3 | 氯水 |
C. | NH4Cl | AgNO3 |
D. | H2SO4 | BaS |
A.A B.B C.C D.D
【解答】解:A.Na2CO3溶液呈碱性,和等物质的量的HAc溶液混合,HAc+Na2CO3=NaHCO3+NaAc,混合后溶液中的溶质是NaHCO3、NaAc,离子浓度减小,导电性减小,溶液呈碱性,酸碱性无显著改变,故A错误;
B.Na2SO3溶液呈碱性,和等物质的量的氯水溶液混合,Cl2+Na2SO3+H2O=Na2SO4+2HCl,混合后溶液中的溶质是Na2SO4、HCl,离子浓度增大,导电性显著增加,溶液呈酸性,酸碱性显著改变,故B正确;
C.NH4Cl溶液呈酸性,和等物质的量的AgNO3溶液混合,NH4Cl+AgNO3=AgCl↓+NH4NO3,混合后溶液中的溶质是NH4NO3,离子浓度减小,导电性减小,溶液呈酸性,酸碱性无显著改变,故C错误;
D.H2SO4溶液呈酸性,和等物质的量的BaS溶液混合,H2SO4+BaS=BaSO4↓+H2S↑,离子浓度明显变小,导电性显著减小,溶液呈中性,酸碱性显著改变,故D错误;
故选:B。
【2023港澳台高考】8.(4分)能正确表达下列反应的离子方程式为( )
A.碘化亚铁溶液与浓硫酸反应:2Fe2++SO42-+4H+═2Fe3++SO2↑+2H2O
B.硫酸铝溶液与过量的浓氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
C.硫酸铜溶液与碘化钾溶液反应:2Cu2++2I﹣═2Cu++I2
D.硫酸锌溶液和硫化钡溶液反应:Zn2++Ba2++2S2﹣+2H2O═ZnS•Ba(OH)2↓+H2S↑
【解答】解:A.还原性:I﹣>Fe2+,则碘化亚铁溶液与浓硫酸反应为2I﹣+H2SO4(浓)=I2+SO2↑+H2O或4I﹣+2Fe2++6H2SO4(浓)=2I2+2Fe3++3SO2↑+3SO42-+6H2O,故A错误;
B.硫酸铝溶液与过量的浓氨水反应生成Al(OH)3沉淀和(NH4)2SO4,Al(OH)3不溶于过量的氨水,则离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B正确;
C.硫酸铜溶液与碘化钾溶液反应生成白色CuI沉淀、K2SO4和I2,离子方程式为2Cu2++2I﹣═2CuI↓+I2,故C错误;
D.Zn2++Ba2++S2﹣+SO42-═ZnS•BaSO4↓,故D错误;
故选:B。
【2023港澳台高考】9.(4分)采用如图所示装置电解饱和硫酸氢钾溶液制备过二硫酸钾(K2S2O8),下列有关叙述正确的是( )

A.在阳极a生成K2S2O8
B.过二硫酸钾中氧的化合价均为﹣2
C.电池总反应为2H2O═O2+2H2↑
D.b为阴极,发生反应2HSO4-═S2O82-+2H++2e﹣
【解答】解:A.K2S2O8中有2个O原子为﹣1价,a为阳极,在阳极上氧元素化合价升高,生成K2S2O8,故A正确;
B.过二硫酸钾(K2S2O8)中氧的化合价均为﹣2和﹣1价,故B错误;
C.阳极电极反应为2HSO4-﹣2e﹣+2H+═S2O82-+2H2O,阴极的电极反应为:反应2H++2e﹣═H2↑,则电池总反应为为2HSO4-+4H+ S2O82-+2H2O+H2↑,故C错误;
S2O82-+2H2O+H2↑,故C错误;
D.b为阴极,发生反应2H++2e﹣═H2↑,故D错误;
故选:A。
【2023港澳台高考】10.(4分)通常条件下,下列各组物质的性质排列顺序错误的是( )
A.熔点:SiO2>P2O5>SO3
B.水中溶解度:CH4>NH3>HF
C.沸点:异丙醇>乙醇>甲醇
D.酸性:HNO3>H2CO3>H3BO3
【解答】解:A.SiO2是共价晶体,熔点最高,P2O5和SO3是分子晶体,P2O5的相对分子质量大于SO3的相对分子质量,故熔点,P2O5>SO3,所以熔点:SiO2>P2O5>SO3,故A正确;
B.NH3和HF能和水形成分子间氢键,故易溶于水,因为F的电负性是大于N的,所以相应地,HF与水形成的氢键,相对于NH3与水形成的氢键也就更强,所以,HF在水中的溶解度大于NH3,所以水中溶解度:CH4>HF>NH3,故B错误;
C.一元醇的熔沸点随着碳原子个数的增大而升高,沸点:异丙醇>乙醇>甲醇,故C正确;
D.元素的非金属性越强,其最高价氧化物水化物的酸性越强,非金属性N>C>B,故酸性HNO3>H2CO3>H3BO3,故D正确;
故选:B。
【2023港澳台高考】11.(4分)由金属镁和氧气生成氧化镁的相关反应及其热效应(kJ•mol﹣1)如图所示。由此可判断ΔH等于( )

A.725kJ•mol﹣1
B.﹣725kJ•mol﹣1
C.1929kJ•mol﹣1
D.﹣1929kJ•mol﹣1
【解答】解:根据盖斯定律可知:[141+2201+247+△H+(﹣3916)]kJ•mol﹣1=﹣602kJ•mol﹣1,解得△H=725kJ•mol﹣1,
故选:A。
【2023港澳台高考】12.(4分)用如图装置制备HCl气体,下列说法错误的是( )

A.盛装浓H3PO4的是滴液漏斗
B.a中是浓H2SO4
C.b中进气管插到底部是因为HCl易挥发
D.烧杯c中盛的是稀碱溶液
【解答】解:A.盛装浓H3PO4的是滴液漏斗,故A正确;
B.制取的HCl混有水蒸气,需要用浓硫酸除去,a中是浓H2SO4,故B正确;
C.HCl的密度比空气大,导管长进短出,与HCl挥发性无关,故C错误;
D.装置c吸收尾气,装有稀碱溶液,故D正确;
故选:C。
【2023港澳台高考】13.(4分)两种内酯的开环共聚可制备聚酯 ,这两种内酯为( )
,这两种内酯为( )
A. B.
B.
C. D.
D.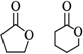
【解答】解: 的单体是
的单体是 和
和 ,
, 水解产物为
水解产物为 和
和 ,故B正确,
,故B正确,
故选:B。
【2023港澳台高考】14.(4分)一种MOFs材料由短周期元素W、X、Y、Z组成,W、X、Y、Z原子序数依次增加,且核外电子数之和等于28,W的电子数与其电子层数相等,X外层电子数是内层的2倍,Z的价层电子数与其电子层数相等。下列叙述不正确的是( )
A.W、X、Y是组成葡萄糖的元素
B.W与Y可组成显弱酸性的化合物
C.W、Y、Z可以组成配合物阴离子
D.X单质的导电性均高于Z单质的
【解答】解:由上述分析可知,W、X、Y、Z分别为H、C、O、Al元素;
A.葡萄糖的化学式为C6H12O6,由H、C、O元素组成,故A正确;
B.H2O2电离的方程式为H2O2⇌HO2-+H+、HO2-⇌H++O22-,则H2O2是弱酸性物质,由H、O元素组成,故B正确;
C.H、O、Al元素可形成阴离子{Al(OH)4]﹣,O与Al原子间存在配位键,故C正确;
D.Al是电的良导体,C的单质有金刚石、石墨、C60等多种,其中金刚石不导电,导电性低于金属铝,故D错误;
故选:D。
【2023港澳台高考】15.(4分)CH3COOH溶液中的物种分布系数与pH的关系如图所示。对于0.10mol•L﹣1的CH3COOH溶液,下列叙述正确的是( )[比如A﹣的分布系数:δ(A﹣)= ]
]

A.水解常数:Kh(CH3COO﹣)>10×10﹣9
B.δ(CH3COO﹣)=
C.pH=7.0时,混合溶液中有c(CH3COO﹣)>c(H+)=c(OH﹣)>c(CH3COOH)
D.采用0.10mol•L﹣1NaOH溶液滴定,指示剂酚酞比甲基橙更准确
【解答】解:A.CH3COO﹣水解方程式为:CH3COO﹣+H2O⇌CH3COOH+OH﹣可得水解常数:Kh(CH3COO﹣)= =c(OH﹣)=10×10﹣9,故A错误;
=c(OH﹣)=10×10﹣9,故A错误;
B.依据题意可知,CH3COO﹣的分布系数为δ(CH3COO﹣)= ,而
,而 =
= =
=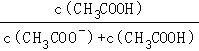 ,则
,则 ≠
≠ ,故B错误;
,故B错误;
C.依据图示可知,pH=7.0时,混合溶液中有c(CH3COO﹣)>c(CH3COOH)>c(H+)=c(OH﹣),故C错误
D.采用0.10mol•L﹣1NaOH溶液滴定,完全反应时生成CH3COONa,溶液显碱性,指示剂酚酞比甲基橙更准确,故D正确;
故选:D。
二、解答题:本大题包括16~20题,共80分。
【2023港澳台高考】16.(16分)咖啡酸苯乙酯(CAPE)是蜂胶要成分之一,有较强抗炎作用,其结构简式为(图1);某研究组以苯及咖啡酸(E)为原料合成CAPE的路线如图2。

回答下列问题:
(1)A的化学名称为 乙苯 。
(2)由A生成B的反应类型为 氧化反应 。
(3)由B生成C的化学方程式为 2 +O2
+O2 2
2 。
。
(4)D的结构简式为  。
。
(5)E的分子式为 C9H8O4 。
(6)F为E的芳香同分异构体,1molF与足量饱和NaHCO3溶液反应可产生2molCO2,F可能的结构共有 10 种,其中核磁共振氢谱有4组峰,且峰面积比为3:2:2:1的有  (写结构简式)。
(写结构简式)。
【解答】解:(1)由分析知,A为 ,其名称为乙苯,
,其名称为乙苯,
故答案为:乙苯;
(2)加氧去氢为氧化反应,由A、B的结构简式可知,A生成B的反应类型为氧化反应,
故答案为:氧化反应;
(3)B生成C的化学方程式为:2 +O2
+O2
 ,
,
故答案为:2 +O2
+O2 2
2 ;
;
(4)由分析知,D的结构简式为: ,
,
故答案为: ;
;
(5)由分析知,E的结构简式为: ,分子式为:C9H8O4,
,分子式为:C9H8O4,
故答案为:C9H8O4;
(6)F为E的芳香同分异构体,1molF与足量饱和NaHCO3溶液反应可产生2molCO2,则F中含有两个羧基,则F可能为苯环上含有一个取代基,结构简式为 ,若苯环上含有两个取代基,含有﹣CH2COOH和﹣COOH两个取代基,有邻间对3种,若苯环上含有三个取代基,即一个﹣CH3,两个﹣COOH,当两个﹣COOH处于邻位时,有
,若苯环上含有两个取代基,含有﹣CH2COOH和﹣COOH两个取代基,有邻间对3种,若苯环上含有三个取代基,即一个﹣CH3,两个﹣COOH,当两个﹣COOH处于邻位时,有 ,共2种,当两个﹣COOH处于间位时,
,共2种,当两个﹣COOH处于间位时, ,共3种,当两个﹣COOH处于对位时,有
,共3种,当两个﹣COOH处于对位时,有 ,共1种,因此F可能的结构共有10,其中核磁共振氢谱有4组峰,且峰面积比为3:2:2:1的有
,共1种,因此F可能的结构共有10,其中核磁共振氢谱有4组峰,且峰面积比为3:2:2:1的有 、
、 ,
,
故答案为:10 、
、 。
。
【2023港澳台高考】17.(16分)无水三氯化铝是重要的化学试剂(三氯化铝易升华,升华点178℃),可作为有机合成的催化剂。一种工业制法如图所示:
(1)制备反应前,应该预通入一段时间的氯气,目的是 排尽装置内的空气,避免空气中的氧气和铝反应生成氧化铝 。
(2)反应炉中发生的主要反应是 2Al+3Cl2 2AlCl3 。为使反应更快进行,可采取的措施是 适当升高温度 。
2AlCl3 。为使反应更快进行,可采取的措施是 适当升高温度 。
(3)进入捕集器的混合气体有 Cl2、AlCl3 ;降温,AlCl3变为固体,该变化称为 凝华 。
(4)吸收器中的溶液可由电解食盐水制得,吸收器中发生反应的化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O 。
(5)三氯化铝在潮湿的空气中不稳定,其原因是 氯化铝与水反应发生水解反应生成氢氧化铝和HCl 。因此,进入反应炉的氯气需要 干燥 。

【解答】解:(1)制备反应前,应该预通入一段时间的氯气,目的是:排尽装置内的空气,避免空气中的氧气和铝反应生成氧化铝,
故答案为:排尽装置内的空气,避免空气中的氧气和铝反应生成氧化铝;
(2)反应炉中发生的主要反应是:2Al+3Cl2 2AlCl3,为使反应更快进行,可采取的措施是:适当升高温度,加快反应速率,
2AlCl3,为使反应更快进行,可采取的措施是:适当升高温度,加快反应速率,
故答案为:2Al+3Cl2 2AlCl3;适当升高温度;
2AlCl3;适当升高温度;
(3)进入捕集器的混合气体有:Cl2、AlCl3,降温,AlCl3变为固体,该变化称为:凝华,
故答案为:Cl2、AlCl3;凝华;
(4)吸收器中的溶液可由电解食盐水制得,吸收器中发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)三氯化铝在潮湿的空气中不稳定,是氯化铝与水反应发生水解反应生成氢氧化铝和HCl,反应化学方程式为:AlCl3+3H2O=Al(OH)3+3HCl↑,因此,进入反应炉的氯气需要干燥,
故答案为:氯化铝与水反应发生水解反应生成氢氧化铝和HCl;干燥。
【2023港澳台高考】18.(16分)乙酰苯胺可作为退热剂。纯乙酰苯胺为白色晶体,熔点114.3℃,微溶于水,易溶于有机溶剂。某粗乙酰苯胺含少量不溶于水的杂质,可通过重结晶提纯。乙酰苯胺在水中的溶解度如表:
t/℃ | 20 | 50 | 80 | 100 |
溶解度/(g/100mL) | 0.46 | 0.84 | 3.45 | 5.5 |
回答下列问题:
(1)重结晶时,加水量应根据粗乙酰苯胺的量和其在 20 ℃时的溶解度计算确定。
(2)若加热时不慎碰倒酒精灯而使酒精洒出起火,应立即用 湿抹布 盖灭。
(3)下列玻璃仪器中,重结晶实验不需要的是 分液漏斗和容量瓶 (填名称)。

(4)加热溶解后进行热过滤,若滤纸上有较多晶体析出,可能的原因有 加热溶解时,温度较低,晶体没有全部溶解;热过滤时,温度降低,晶体析出 (答出两条)。不能将滤纸上析出的晶体合并到滤液中,原因是 含有不溶于水的杂质 。
(5)结晶时,如果想要得到较大的晶体,可采取的方法有 C 。(填标号)
A.搅拌
B.快速降温
C.缓慢降温
过滤后,可用来洗涤晶体的是 B 。(填标号)
A.乙醇
B.冷水
C.热水
【解答】解:(1)由于乙酰苯胺在20℃时,溶解度较小,则重结晶时,加水量应根据粗乙酰苯胺的量和其在 20℃时的溶解度计算确定,
故答案为:20;
(2)若加热时不慎碰倒酒精灯而使酒精洒出起火,应立即用湿抹布盖灭,
故答案为:湿抹布;
(3)重结晶操作为加热溶解,趁热过滤,冷却结晶再过滤,故重结晶实验不需要的是分液漏斗和容量瓶,
故答案为:分液漏斗和容量瓶;
(4)加热溶解后进行热过滤,若滤纸上有较多晶体析出,可能的原因有加热溶解时,温度较低,晶体没有全部溶解;热过滤时,温度降低,晶体析出;不能将滤纸上析出的晶体合并到滤液中,原因是含有不溶于水的杂质,
故答案为:加热溶解时,温度较低,晶体没有全部溶解;热过滤时,温度降低,晶体析出;含有不溶于水的杂质;
(5)结晶时,缓慢降温,可以得到较大的晶体,
故答案为:C;
(6)由于乙酰苯胺微溶于水,易溶于有机溶剂,且随着温度的升高,溶解度减小,则过滤后,可用来洗涤晶体的是冷水,
故答案为:B。
【2023港澳台高考】19.(16分)在326℃的密闭刚性容器中,1,3﹣丁二烯(C4H6)在催化剂A作用下发生二聚反应:2C4H6(g)═C8H12(g)ΔH=﹣80kJ•mol﹣1。不同时刻测得容器中的压强如表所示:
t/min | 0 | 3.25 | 12.18 | 24.55 | 42.50 | 68.05 | ∞ |
p/kPa | 84.25 | 82.45 | 77.87 | 72.85 | 67.89 | 63.26 | 47.61 |
回答下列问题(列出计算表达式即可):
(1)成立t=24.55min时,C4H6(g)的转化率α= 27 %。
(2)3.25~24.55min之间的平均速率 (C8H12)= 0.45 kPa•min﹣1。
(C8H12)= 0.45 kPa•min﹣1。
(3)该反应的平衡常数Kp=  kPa﹣1。
kPa﹣1。
(4)若提高反应温度,则平衡时容器中的压强 大于 (填“大于”“小于”或“等于”)47.61kPa。
(5)保持反应温度不变,改用催化剂B,发现平衡时容器中的压强小于47.61kPa。分析可能的原因是 1,3﹣丁二烯(C4H6)在催化剂B作用下生成了高聚物 。
【解答】解:(1)结合三段式列式计算,设起始1,3﹣丁二烯(C4H6)物质的量为2mol,生成二聚物物质的量为xmol,气体压强之比等于气体物质的量之比,
2C4H6(g)═C8H12(g)
起始量(mol) 2 0
变化量(mol) 2x x
24.55min时(mol)2﹣2x x
 =
= ,x≈0.27,转化率=
,x≈0.27,转化率= ×100%=
×100%= ×100%=
×100%= ×100%=27%,
×100%=27%,
故答案为:27%;
(2)气体压强减小量和C8H12生成的量相同,3.25~24.55min之间的平均速率 (C8H12)=
(C8H12)= =
= ≈0.45kPa•min﹣1,
≈0.45kPa•min﹣1,
故答案为:0.45;
(3)平衡状态下气体压强47.61kPa,结合三段式列式计算,设起始1,3﹣丁二烯(C4H6)物质的量为2mol,平衡状态下生成C8H12(g)物质的量为ymol,
2C4H6(g)═C8H12(g)
起始量(mol)2 0
变化量(mol)2y y
平衡量(mol)2﹣2y y
气体压强之比等于气体物质的量之比, =
= ,y≈0.87,平衡状态下气体总物质的量=2mol﹣0.87mol=1.13mol,Kp=
,y≈0.87,平衡状态下气体总物质的量=2mol﹣0.87mol=1.13mol,Kp= =
= kPa﹣1
kPa﹣1
故答案为: ;
;
(4)反应为放热反应,若提高反应温度,平衡逆向进行,气体物质的量增大,则平衡时容器中的压强大于47.61kPa,
故答案为:大于;
(5)保持反应温度不变,改用催化剂B,发现平衡时容器中的压强小于47.61kPa。分析可能的原因是:1,3﹣丁二烯(C4H6)在催化剂B作用下生成了高聚物,
故答案为:1,3﹣丁二烯(C4H6)在催化剂B作用下生成了高聚物。
【2023港澳台高考】20.(16分)[C(NH2)3][SO3F]是一种新型的紫外线非线性晶体材料。回答下列问题:

(1)组成[C(NH2)3][SO3F]的所有元素中,电负性最大的是 F ,基态原子p轨道为半充满的元素是 N 。(填元素符号)
(2)[C(NH2)3]+中碳原子σ键的轨道重叠方式为 A (填图1标号)。其中碳原子的杂化类型为 sp3杂化 、碳原子杂化方式与[C(NH2)3]+中的碳相同,且只含有一个碳原子的有机物结构简式为 CH4、CH3OH 。(写出两个)
(3)[C(NH2)3][SO3F]的晶体类型为 离子晶体 ,[SO3F]﹣的空间构型为 四面体形 。晶体中单层[C(NH2)3][SO3F]结构如图2所示,其中[C(NH2)3]+与[SO3F]﹣之间的作用力包括 离子键 氢键 。
【解答】解:(1)根据分析可知,组成[C(NH2)3][SO3F]的所有元素中,电负性最大的是F,基态原子p轨道为半充满的元素是N,
故答案为:F;N;
(2)[C(NH2)3]+中碳原子为sp3杂化,N原子也是sp3杂化,σ键的轨道重叠方式为杂化轨道之间的头碰头重叠,即A符合题意,其中碳原子的杂化类型为sp3杂化、碳原子杂化方式与[C(NH2)3]+中的碳相同,且只含有一个碳原子的有机物可以CH4、CH3OH,
故答案为:A;sp3杂化;CH4、CH3OH;
(3)根据题意可知,[C(NH2)3][SO3F]是由[C(NH2)3]+与[SO3F]﹣构成,故其晶体类型为离子晶体,[SO3F]﹣中S的价层电子对数=4+ =4,由于C﹣F键的键长不等于C﹣O单键、C=O双键的键长,所以其空间构型为四面体形,晶体中单层[C(NH2)3][SO3F]结构如图2所示,其中[C(NH2)3]+与[SO3F]﹣之间的作用力包括离子键、氢键,
=4,由于C﹣F键的键长不等于C﹣O单键、C=O双键的键长,所以其空间构型为四面体形,晶体中单层[C(NH2)3][SO3F]结构如图2所示,其中[C(NH2)3]+与[SO3F]﹣之间的作用力包括离子键、氢键,
故答案为:离子晶体;四面体形;离子键、氢键。
三、计算题:共10分。
21.(10分)CdS既是一种颜料,又是一种感光材料。常采用向可溶性镉盐溶液中通入H2S气体使其饱和[c(H2S)=0.1mol•L﹣1],调节溶液的pH来生产CdS。欲使沉淀的溶液中c(Cd2+)达到国家Ⅱ类地表水质量控制标准c(Cd2+)≤10﹣7.4mol•L﹣1(即≤0.005mg•L﹣1),计算沉淀时应控制溶液的最低pH为多少?已知:Ka1(H2S)=10﹣7.0、Ka2(H2S)=10﹣12.9及Ksp(CdS)=10﹣26.1。
【解答】解:Ksp(CdS)=c(Cd2+)×c(S2﹣)=10﹣26.1,当c(Cd2+)达到国家Ⅱ类地表水质量控制标准c(Cd2+)≤10﹣7.4mol•L﹣1时,c(S2﹣)= =
= mol•L﹣1=10﹣18.7mol•L﹣1,又Ka1(H2S)×Ka2(H2S)=
mol•L﹣1=10﹣18.7mol•L﹣1,又Ka1(H2S)×Ka2(H2S)= =10﹣7.0×10﹣12.9,即
=10﹣7.0×10﹣12.9,即 =10﹣19.9,解得c(H+)=10﹣1.1mol•L﹣1,pH=﹣lgc(H+)=1.1,则淀时应控制溶液的最低pH为1.1,
=10﹣19.9,解得c(H+)=10﹣1.1mol•L﹣1,pH=﹣lgc(H+)=1.1,则淀时应控制溶液的最低pH为1.1,
答:沉淀时应控制溶液的最低pH为1.1。

- 全部评论(0)




