1-9号元素及其化合物知识要点简介
时间:2024-03-21 10:32 来源:未知 作者:张德金 点击: 次 所属专题: 元素化合物简介
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氢H
1、H,是原子半径最小的元素,有H(氕)、D(氘)、T(氚)等核素。H2、D2、HD混合在一起,仍然是纯净物氢气。
(1)H2主要体现为还原性。
2H2+O2=点燃=2H2O
CuO+H2=Δ=Cu+H2O
(2)特殊情况下也有氧化性。
与活泼金属在隔绝空气下加热反应,得到金属氢化物,显示H2有氧化性。
与Ca的反应为:Ca+H2=Δ=CaH2
2、金属氢化物与水反应能产生H2。NaH的电子式为Na+[:H]-,与水的反应:
NaH+H2O=NaOH+ H2↑
NaAlH4为更强的还原剂,在碱性溶液条件下能将乙酸还原为乙醇,产物为NaAl(OH)4。
2CH3COOH+2H2O +NaAlH4=2CH3CH2OH+NaAl(OH)4
3、水溶液中H+实际以H3O+存在。
4、工业制H2主要用气态烃和水蒸气在高温下得到。甲烷与水蒸气生成CO2和氢气的反应:
CH4+2H2O=高温=CO2+4H2
5、D(氘)、T(氚)等核聚变及相关设备研究、氢气能源的贮存方法,是当今世界的前沿课题。

二、锂Li
含Li的主要矿物有锂辉石LiAlSi2O6等。用于制造低密度合金和锂电池。
1、银白色金属,较活泼,易与空气中的氧气反应。
密度比煤油小,要保存石蜡油中。
(1)Li在空气中燃烧生成Li2O。
4L i+O2=点燃=2L i2O
(2)遇水慢慢会反应,
2L i+2H2O=2L iOH+H2↑
(3)它是制造锂电池的重要金属。

锂电池的电解质溶液为非水溶液,传导离子为Li+。
以xLi+Li1-xMnO2=LiMnO2
电解质为熔融Li2O的电池为例:
放电时的负极反应为xLi-xe-=xLi+
正极反应为xLi++xe-+Li1-xMnO2=LiMnO2
2、LiOH为强碱,溶于水。Li2CO3、LiF、Li3PO4难溶于水。
3、工业制锂用电解LiCl制得。
2LiCl(熔融)=电解=2Li+Cl2↑
三、铍Be
绿柱石、祖母绿[Be3Al2(SiO3)6]、海蓝宝石等,都含有Be。

1、铍及其化合物都有剧毒。
2、铍、铝性质比较
在周期表中,铍与铝处于周期表的对角线位置,它们的性质十分相似。

(1)都是活泼金属。但都不和水反应。
(2)都是亲氧元素,金属表面易形成氧化物保护膜,都能被浓HNO₃钝化。
铍比铝和钛都轻,强度是钢的四倍。铍的吸热能力强,机械性能稳定,是制造火箭和卫星的结构材料。
(3)均为两性金属。氧化物、氢氧化物也均呈两性。
Be+2HCl=BeCl2+H2↑
Be+2NaOH+2H2O=Na2[Be(OH)4]+H2↑
(4)氧化物BeO和Al2O3都具有高熔点、高硬度,可做耐高温材料。
BeO能像镜子反射光线一样把中子反射回去,而且熔点高,特别能耐高温,是原子反应堆里中子反射层的最好材料。
(5)BeCl2和AlCl3都是缺电子的共价型化合物,易通过桥键形成聚合分子。
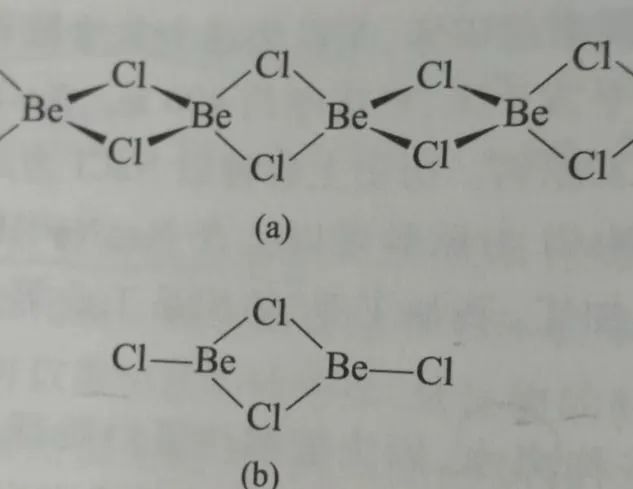
氯化铍的二聚体和多聚体
BeCl2中Be周围有两对共用电子对,属sp杂化,分子呈直线形。
Be2Cl4中Be周围有三对共用电子对,属sp2杂化,分子呈平面形。
(BeCl2)n中Be周围有四对共用电子对,属sp3杂化。
(6)铍盐、铝盐都易水解,水解显酸性。
BeCl2+2H2O= Be(OH)2+2HCl↑
3、应用
(1)金属铍透过x射线的能力强,有金属玻璃之称,是制造x射线管小窗口的材料。
(2)在原子反应堆里,铍是能够提供大量中子炮弹的中子源;铍对快中子还有很强的减速作用,是原子反应堆中最好的中子减速剂。
四、硼B

硼和硼砂
硼砂(Na2B4O7·10H2O)。
1、硼的导电率随着温度的升高而增大,高温时为良导体。
(1)与非金属作用
常温下与氟气反应。在空气中能燃烧,生成B₂O₃。
高温下B能与N₂、S、其它卤素单质等反应。
(2)B是亲氧元素,能从许多稳定的氧化物(如SiO₂,P₂O₅,H₂O等)中夺取氧而用作还原剂。例如在赤热下,B与水蒸气作用生成硼酸和氢气:
2B+6H₂O=Δ=H₃BO₃+ 3H₂↑
(3)与酸作用
硼不与盐酸作用,但与热浓H₂SO₄,热浓HNO₃作用生成硼酸:
2B+3H₂SO₄(浓)=Δ=2H₃BO₃+3SO₂↑
B+3HNO₃(浓)=Δ=H₃BO₃+ 3NO₂↑
(4)与强碱作用
在氧化剂存在下,硼和固态强碱共熔得到偏硼酸盐:
2B+2NaOH+3KNO₃=2NaBO₂+3KNO₂+H₂O
(5)与金属作用
高温下硼几乎能与所有的金属反应生成金属硼化物。
(6)制硼:3Mg+B2O3=高温=3MgO+2B
2、H3BO3和B2O3
(1)硼酸,是一元弱酸,溶于水。
(2)电离方程式为H3BO3+H2O⇌H++(OH)4-
(3)与NaOH等强碱能反应。
NaOH+H3BO3=NaB(OH)4
(4)对应的氧化物B2O3为酸性氧化物。
2NaOH(s)+B2O3=Δ=2NaBO2+H2O
2NaOH(aq)+3H2O+B2O3=2NaB(OH)4
(5)硼砂珠实验可定性检测一些金属氧化物。
将金属氧化物与B2O3熔融后冷却,得到偏硼酸盐熔珠。
CuO:蓝色熔珠。Fe2O3:黄色熔珠。MnO:紫色熔珠。NiO:绿色熔珠。
3、BF3为平面正三角形结构,而NH3为三角锥结构,原因是BF3中b原子的最外层有三对电子,为缺电子分子,呈平面三等分分布。
对应的BF4-为含配位键的离子。
4、NaBH4为强还原剂,常在碱性溶液中参加反应,产物为NaB(OH)4。NaBH4碱性溶液将乙醛还原的反应方程式
4CH3CHO+NaBH4+4H2O=4CH3CH2OH+NaB(OH)4
5、B12为正二十面体结构。

晶体硼硬度仅次于金刚石,为共价晶体。

硼晶体的两种结构
6、氮化硼BN为共价晶体。
层状结构的不导电。

氮化硼的两种常见结构
7、应用
(1)硼元素是核糖核酸形成的必需品,而核糖核酸是生命的重要基础构件。
(2)硼是微量合金元素,硼与塑料或铝合金结合,是有效的中子屏蔽材料;硼钢在反应堆中用作控制棒;硼纤维用于制造复合材料等;含硼添加剂可以改善冶金工业中烧结矿的质量。
硼及其化合物也是冶金工业的助溶剂和冶炼硼铁硼钢的原料,加入硼化钛、硼化锂、硼化镍,可以冶炼耐热的特种合金;建材。
硼酸盐、硼化物是搪瓷、陶瓷、玻璃的重要组分,具有良好的耐热耐磨性,可增强光泽,调高表面光洁度等。
硼酸,硼酸锌可用于防火纤维的绝缘材料,是很好的阻燃剂,也应用于漂白、媒染等方面;偏硼酸钠用于织物漂白。硼及其化合物可用于油漆干燥剂,焊接剂,造纸工业含汞污水处理剂等。
(3)健康和农业
硼普遍存在于蔬果中,是维持骨的健康和钙、磷、镁正常代谢所需要的微量元素之一。
硼是高等植物特有的必需元素。硼对植物的生殖过程有重要的影响,与花粉形成、花粉管萌发和受精有密切关系。
五、碳C
1、单质有金刚石、石墨、无定形碳、富勒烯、石墨烯等多种同素异形体。
(1)13C、14C可以测定古物的年代。
(2)是煤的主要成分,重要的工业燃料,主要体现为还原性,可燃。完全燃烧生成CO2。不完全燃烧生成CO。
C+O2=点燃=CO2
2C+O2(不足)=点燃=2CO
C+H2O=高温=CO+ H2(水煤气)
(3)可还原氧化物得到金属或非金属。
2CuO+C=Δ=2Cu+CO2↑
2、CO,无色有毒气体,难溶于水,易与血红蛋白结合,造成缺氧。在北方地区的农村冬天极易造成CO中毒。
(1)常表现为还原性,用于冶炼金属。
工业炼铁的反应
Fe2O3+3CO=高温=2Fe+3CO2
但与KMnO4溶液不反应。
(2)CO有很强的形成配位化合物的能力。可以与镍金属形成四羰基合镍Ni(CO)4。
Ni+4CO= Ni(CO)4
3、CO2,无色气体,比空气重,常温下以体积比1:1溶于水,能在水中产生少量的碳酸。CO2分子中存在两个Π34键。
具有一定的氧化性。与H2、C、一些金属能发生反应。
CO2+C=高温=2CO
Mg在CO2中燃烧:
2Mg+CO2=点燃=2MgO+C

3、H2CO3,二元弱酸,不稳定,易分解。与碱能生成两种盐。
如与NaOH生成NaHCO3、Na2CO3。
NaOH+CO2(少量)=Na2CO3+H2O
NaOH+CO2(过量)=NaHCO3
比碳酸弱的酸主要有H2SiO3、Al(OH)3、HClO、苯酚等。
H2O+CO2+NaClO=NaHCO3+HClO
4、碳酸氢盐都不稳定。遇强酸、强碱都能反应。
2NaHCO3=Δ=Na2CO3+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+NaOH=Na2CO3+H2O
5、碳酸盐
CO32-存在Π46键。
与较强的酸能反应,与Ca2+、Ba2+等生成难溶盐沉淀。
Na2CO3+2HCl(过量)=2NaCl+H2O+CO2↑
Na2CO3+HCl(少量)=NaCl+NaHCO3
Na2CO3+BaCl2=BaCO3↓+2NaCl
除了钠、钾等碱金属的碳酸盐外,多数碳酸盐在高温下也会分解出CO2。
CuCO3=Δ=CuO+CO2↑
6、草酸及盐的性质
(1)H2C2O4,二元弱酸,比碳酸酸性强。
(2)H2C2O4不稳定。
H2C2O4=Δ=CO↑+CO2↑+H2O
(3)H2C2O4有强还原性,与酸性高锰酸钾溶液等发生反应。
5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnsO4+10CO2↑+8H2O
(4)草酸盐也不稳定,受热易分解。
Na2C2O4=Δ= Na2CO3+CO↑
(5)草酸对应的钙盐、钡盐难溶于水。
CaCl2+Na2C2O4=CaC2O4↓+2NaCl
六、氮N
1、NH3,无色刺激性气味气体,极易溶于水,与水以体积比700:1的体积溶于水。用水吸收时要防倒吸。
(1)处于气体状态时,能与HCl、HBr等气体反应。
NH3+HCl=NH4Cl(有白烟产生)
有还原性,与CuO、Cl2、O2等反应。
2NH3+3CuO=Δ=3Cu+N2+3H2O
2NH3(少量)+3Cl2= N2+6HCl
4NH3+3O2=点燃=2N2+6H2O
4NH3+5O2=催化剂/Δ=4NO+6H2O
(2)溶于水后,主要以NH3·H2O形式存在。
NH3·H2O是一元弱碱,在水中不完全电离。
NH3·H2O⇌NH4++OH-
NH3·H2O的碱性强于其它难溶弱碱。
2NH3·H2O+MgCl2=Mg(OH)2↓+2NH4Cl
能以形成配位键的形式发生反应。
AgCl+2NH3·H2O=[Ag(NH3)2]Cl+2H2O
Cu(OH)2+4NH3·H2O=[Cu(NH3)4](OH)2+4H2O
(3)制取NH3
实验室:Ca(OH)2+2NH4Cl=Δ=CaCl2+2NH3↑+2H2O
工业:N2+3H2⇌高温高压/催化剂⇌2NH3
(4)检验NH3
用湿润的红色石蕊试纸,靠近气体,若变蓝,则为NH3。
(5)尿素的合成:
CO2+2NH3=高温高压=H2NCOONH4
H2NCOONH4=高温高压=CO(NH2)2+H2O

2、铵盐NH4+,离子化合物,易溶于水。
(1)稀溶液下与强碱能反应生成NH3·H2O,浓溶液下与强碱在加热时能反应生成NH3。
NaOH+NH4Cl(稀)=NH3·H2O+NaCl
NaOH+NH4Cl(浓)=Δ=NH3↑+H2O+NaCl
(2)固体受热易分解。因为NH4+不稳定,会分解出NH3。若另一种产物有强氧化性,则生成产物不是NH3。
NH4Cl=Δ= NH3↑+HCl↑
NH4HCO3=Δ= NH3↑+H2O+CO2↑
NH4NO3=Δ= N2O↑+2H2O
(3)与亚硝酸盐发生氧化还原反应。
NH4Cl+NaNO2=NaCl+N2↑+2H2O
(4)检验NH4+
加NaOH溶液,并加热,若有能使湿润的红色石蕊试纸变蓝的气体产生,则有NH4+。
3、N2,无色难溶于水的气体,很稳定,常用作保护气。
(1)还原性
N2+O2=放电=2NO
(2)氧化性
3Mg+N2=点燃=Mg3N2
Mg3N2能水解。很多金属的氮化物、硫化物、磷化物、碳化物、氧化物等,都能与水发生类似于水解反应。
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Al2S3+6H2O=Al(OH)3+3H2S↑
Ca3P2+6H2O=3Ca(OH)2+2PH3↑
CaC2+2H2O=Ca(OH)2+C2H2↑
4、NO,无色气体,难溶于水,有毒。
(1)遇空气中的氧气生成红棕色的NO2。
2NO+O2=2NO2
(2)NO和O2一起与水反应:
4NO+3O2+2H2O=4HNO3
5、NO2,红棕色气体,易溶于水,有毒。有Π34键。
(1)与水能发生歧化反应
3NO2+H2O=2HNO3+NO
(2)NO2和O2一起与水反应:
4NO2+O2+2H2O=4HNO3
(3)NaOH溶液可以吸收NO2:
2NO2+2NaOH=NaNO2+NaNO3+H2O
(4)NaOH溶液可以吸收NO与NO2的混合气体:
NO2+NO+2NaOH=2NaNO2+H2O
(5)氮氧化物与氨气能反应。
6NO2+8NH3=7N2+12H2O
(6)自身存在生成N2O4的平衡。
2NO2⇌N2O4

6、硝酸及硝酸盐
(1)HNO3易挥发,有强氧化性,不稳定,受热或见光易分解,存放于棕色细口瓶中。
4HNO3=Δ=4NO2↑+O2↑+2H2O
(2)浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO,更稀的硝酸的还原产物为N2O、N2、铵盐等。只要硝酸过量,铁被氧化时,生成Fe3+。
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
4Cu+10HNO3(极稀)=4Cu(NO3)2+NH4NO3+3H2O
浓硝酸常温下遇铁、铝有钝化现象。
(3)硝酸盐热稳定性较差。NO3-有Π46键。
2NaNO2=Δ=2NaNO2+O2↑(金属活动顺序表中K~Na)
2Cu(NO3)2=Δ=2CuO+ 4NO2↑+O2↑(金属活动顺序表中Mg~Cu)
2AgNO3=Δ=2Ag+2NO2↑+O2↑(Hg、Ag)
(4)硝酸盐在固态加热时,有很强的氧化性。
NaNO3+2FeO=高温=NaNO2+Fe2O3
7、亚硝酸及亚硝酸盐
(1)HNO2为一元弱酸。只存在于稀的水溶液中。亚硝酸不稳定,见光易分解。
2HNO2=NO+NO2+H2O
(2)大多数亚硝酸盐易溶于水。强碱的亚硝酸盐具有较高的热稳定性。NO2-有Π34键。
(3)亚硝酸及盐有强氧化性。
2HNO2+2KI+H2SO4=2NO↑+I2+K2SO4+2H2O
(4)亚硝酸及盐也有强还原性。
NaNO2+Cl2+H2O=NaNO3+2HCl
8、硝酸的工业制法
N2→NH3→NO→NO2→HNO3

七、氧O
1、O2是自然界最重要的氧化剂,也是造成自然界各种氧化反应的最重要原因。
2、工业用氧,是用液化分离空气法得到。
3、实验室主要用KMnO4、KClO3、H2O2制得。
2KMnO4=Δ=K2MnO4+MnO2+O2↑
2H2O2= MnO2/Δ=2H2O+O2↑
2KClO3= MnO2/Δ=2KCl+3O2↑
4、O2也有还原性,能被更强的氧化剂F2氧化为OF2。
5、氧化物分为酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物、不成盐氧化物等。
(1)酸性氧化物:与碱、碱性氧化物反应,生成盐。
Mn2O7+2KOH=2KMnO4+H2O
(2)碱性氧化物:与酸、酸性氧化物反应,生成盐。
MnO+2HCl=MnCl2+H2O
(3)两性氧化物:既能与酸、酸性氧化物反应,生成盐。又能与碱、碱性氧化物反应,生成盐。
Al2O3+CaO=Δ=Ca(AlO2)2
Al2O3+6HCl=2AlCl3+3H2O
(4)复杂氧化物:由元素的多种价态形成的氧化物。
Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O(Pb有+2、+4,其中+4有强氧化性)
(5)不成盐氧化物
CO、NO等。
6、双氧水(H2O2)

(1)不稳定。2H2O2=MnO2=2H2O+O2↑(Cu2+、Fe3+等也可以做催化剂)
(2)有强氧化性。可用作漂白剂、消毒剂等。
H2O2+SO2=H2SO4
(3)有还原性。
5H2O2+2KMnO4+3H2SO4=K2SO4+2MnsO4+5O2↑+8H2O
(4)Fe3+催化H2O2分解的催化原理为:
2Fe3++H2O2=2Fe2++2H++O2↑
2Fe2++H2O2+2H+=2Fe3++2H2O
(5)其它的过氧化物也有不稳定性、强氧化性、强还原性等。
(6)分子结构

7、臭氧O3
(1)O2的同素异形体,是极性分子。
(2)臭氧有强氧化性。
PbS+4O3=PbSO4+4O2
(3)可作空气净化剂,消毒杀菌剂,有水存在时臭氧是一种强力漂白剂,并且产物为O2,不产生二次污染。
(4)臭氧存在于大气中,可吸收太阳光中的紫外线,使生物免受伤害。

八、氟F
1、F2
(1)淡黄绿色气体。
(2)氧化能力超强。几乎能与除全氟化物之外的所有无机物和有机物反应。
(3)遇氢气就爆炸。
H2+F2=2HF
(4)遇水立刻反应,与水溶液反应时,先和水反应。
2F2+2H2O=4HF+O2
2、HF:
(1)有氢键,熔沸点比HCl、HBr等高。
(2)在水溶液中为弱酸。
(3)腐蚀能力强,一般保存在塑料瓶中。对皮肤、肌肉、骨胳有强腐蚀性,碰到立刻用大量水冲洗,并用钙或镁的可溶性盐洗。
(4)其水溶液能腐蚀玻璃。
SiO2+4HF=SiF4↑+2H2O
Si+4HF=SiF4↑+2H2↑
3、F‑有很强地形成配位键的能力。
CaF2难溶于水。MgF2微溶于水。


- 全部评论(0)
