氧化还原反应的规律及其应用
时间:2006-09-05 09:57 来源: 作者:赵亭 点击:次 所属专题: 氧化还原反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一. 表现性质规律
当元素具有可变化合价,一般化合价处于最高价态时只具有氧化性;处于最低价态时只具有还原性;处于中间价态时既具有氧化性又具有还原性。利用此规律可判断物质是否具有氧化性及还原性,但不能判断物质氧化性及还原性的强弱。
例1. 下列各组物质中,每种物质都既能被氧化又能被还原的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
解析:每种物质都既能被氧化又能被还原,即每种物质都既具有还原性又具有氧化性,利用上述规律可逐一筛选。
A项中,![]() 都含有中间价态的元素,它们既能被氧化又能被还原,但
都含有中间价态的元素,它们既能被氧化又能被还原,但![]() 一般只具有氧化性,虽然其中含有
一般只具有氧化性,虽然其中含有![]() 价的氧元素却很难被氧化。
价的氧元素却很难被氧化。
B项中,![]() ,一般只能被还原。
,一般只能被还原。
C项中,![]() 和
和![]() 分子中既含较高价态的氢元素,又含有较低价态的硫元素或氯元素,
分子中既含较高价态的氢元素,又含有较低价态的硫元素或氯元素,![]() 中的S显+4价,属于硫元素的中间价态,故该组中每种物质都既能被氧化,又能被还原。
中的S显+4价,属于硫元素的中间价态,故该组中每种物质都既能被氧化,又能被还原。
D项中,![]() 中+1价钠元素氧化性极弱,故
中+1价钠元素氧化性极弱,故![]() 只具有还原性。
只具有还原性。
答案:(C)。
二. 两强两弱规律
在氧化还原反应中:
强氧化性物质+强还原性物质![]() 弱氧化性物质+弱还原性物质
弱氧化性物质+弱还原性物质
氧化剂 还原剂 氧化产物 还原产物
即氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,利用此规律可判断在相同条件下物质氧化性及还原性的强弱以及在同一状态下能否发生氧化还原反应。
例2. 有A2、B2、C2三种单质进行如下反应:
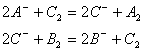
(1)三种单质的氧化性由强到弱的顺序是:__________________。
(2)三种离子的还原性由强到弱的顺序是:__________________。
(3)若![]() 能发生
能发生![]() 反应,那么
反应,那么![]() 能否发生反应?_______________理由是_______________。
能否发生反应?_______________理由是_______________。
解析:利用两强两弱规律由前一方程式可判断氧化性![]() ,还原性
,还原性![]() ,后一方程式可判断出氧化性
,后一方程式可判断出氧化性![]() ,还原性
,还原性![]() 。
。
则这三种单质氧化性的顺序是![]() ,这三种离子的还原性顺序是
,这三种离子的还原性顺序是![]()
由(3)若![]() 能发生
能发生![]() 反应,即可判断氧化性
反应,即可判断氧化性![]() ,而前边已判断
,而前边已判断![]() ,则
,则![]() ,所以
,所以![]() 不能发生反应,若反应,则不符合两强两弱规律。
不能发生反应,若反应,则不符合两强两弱规律。
三. 先强后弱规律
同一氧化剂与含多种还原性物质的溶液反应时,首先被氧化的是还原性较强的物质;同一还原性物质与含有多种氧化性物质的溶液反应时,首先被还原的是氧化性较强的物质,利用此规律,可判断物质发生氧化还原反应的实质及进行有关氧化还原反应的定量分析及计算:
例3. 已知![]() ,判断在含
,判断在含![]() 溶质的溶液中通入
溶质的溶液中通入![]() ,被氧化
,被氧化![]() 的物质的量为_______________。反应的离子方程式是__________。
的物质的量为_______________。反应的离子方程式是__________。
解析:由![]() 反应方程式可判断
反应方程式可判断![]() 的还原性大于
的还原性大于![]() 的还原性,在含
的还原性,在含![]() 溶液中,通入
溶液中,通入![]() 首先与
首先与![]() 发生反应。
发生反应。

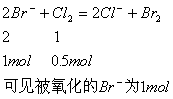
反应的离子方程式:
![]()
四. 价态归中和歧化反应规律
价态归中反应是指含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价![]() 中间价”,而不会出现交错现象。歧化反应是指含相同价态同种元素自身氧化还原反应,反应时该元素价态一定遵循“中间价
中间价”,而不会出现交错现象。歧化反应是指含相同价态同种元素自身氧化还原反应,反应时该元素价态一定遵循“中间价![]() 高价+低价”。
高价+低价”。
可见,价态归中和歧化是指相同元素之间氧化还原反应,利用此规律可判断同种元素在氧化还原反应中化合价变化,及含同一种元素不同价态的物质之间能否发生氧化还原反应。
例4. 已知G、Q、X、Y、Z均为含氯元素的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有下列转化关系(未配平)
(1)![]()
(2)![]()
(3)![]()
(4)![]()
这五种化合物中氯元素的化合价由低到高的顺序是__________________。
A. G Y Q Z X B. X Z Q G Y
C. X Z Q Y G D. G Q Y Z X
解析:利用此规律由(1)可知因生成![]() 中
中![]() 元素化合价为
元素化合价为![]() 价(最低价),低于G中氯元素的化合价,所以Q中氯元素化合价必高于G中氯元素的化合价。由(2)可知,因生成氢气,氢元素化合价降低,所以氯元素的化合价必升高,X中氯元素的化合价高于Q中氯元素的化合价。由(3)可知,Y中氯元素的化合价介于G与Q之间,且比G中氯元素的化合价高,比Q中氯元素的化合价低,由(4)可知,Z中氯元素的化合价介于Q与X之间,且比Q中氯元素的化合价高,比X中氯元素化合价低。
价(最低价),低于G中氯元素的化合价,所以Q中氯元素化合价必高于G中氯元素的化合价。由(2)可知,因生成氢气,氢元素化合价降低,所以氯元素的化合价必升高,X中氯元素的化合价高于Q中氯元素的化合价。由(3)可知,Y中氯元素的化合价介于G与Q之间,且比G中氯元素的化合价高,比Q中氯元素的化合价低,由(4)可知,Z中氯元素的化合价介于Q与X之间,且比Q中氯元素的化合价高,比X中氯元素化合价低。
答案:(A)。
五. 电子得失相等规律
电子得失相等也就是说,还原剂失去电子的总数等于氧化剂得到电子的总数,此规律是进行氧化还原反应方程式配平的依据。也是进行氧化还原反应有关计算的关键。
列5. 24mL浓度为0.05mol![]() 的
的![]() 溶液恰好与20mL浓度为
溶液恰好与20mL浓度为![]() 的
的![]() 溶液完全反应,已知
溶液完全反应,已知![]() 被
被![]() 氧化为
氧化为![]() ,则元素
,则元素![]() 在还原产物中的化合价为( )
在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
解析:根据氧化还原反应中得失电子相等规律,可判断Cr元素还原产物里的价态
![]()
![]()

答案:B。
以上着重介绍了氧化还原反应的五个最基本规律,学习氧化还原反应只有掌握其基本规律,才能抓住本质,深刻理解,灵活应用。

- 全部评论(0)
