氧化还原反应24条基本规律
时间:2016-01-17 21:30 来源:未知 作者:谢文芳 点击:次 所属专题: 氧化还原反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、元素化合价与物质氧化性和还原性的关系
1、元素处于高价的物质一般只具有氧化性,在一定条件下可与还原剂反应,在生成的新物质时,该元素的化合价降低。如:KMnO4、KClO3、FeCl3等,遇还原剂时Mn+7、Cl+5、Fe+3元素化合价降低,被还原。
2、元素处于低价的物质一般只具有还原性,在一定条件下可与氧化剂反应,在生成的新物质中,该元素的化合价升高。如:H2SO4(浓)+2HI==I2+SO2↑+2H2O,其中HI中I处于最低-1价,HI具有较强的还原性,可被浓H2SO4氧化成I2,化合价升高。再如:CO、SO2、H2S、HCl、Na2SO3、FeSO4中处于低价的元素,均可表现较强的还原性。
3、元素处于中间价态时,该物质既有氧化性,又有还原性。遇到强氧化剂,它作还原剂,遇到强还原剂,它作氧化剂。如:H2O2,当遇到强氧化剂KMnO4时,它只作还原剂,被氧化为O2;当遇到强还原剂H2S时,它只作氧化剂,被还原为H2O.
注意:最高价元素的物质可以有氧化性,但不一定为强氧化剂,最低价元素的物质可以有还原性,但不一定为强还原剂。如:Na2O中Na为其最高正价,但氧化性很弱,而H2O中,O为其最低负价,但还原性很弱。
二、影响物质氧化性、还原性的几种主要因素
事物的外在因素总是通过主观因素起作用。氧化还原反应之所以能够发生,是由氧化剂和还原剂本身性质所决定的。氧化剂和还原剂的相当强弱达到一定程度时才能发生氧化还原反应。一般来说只有强氧化剂和强还原剂才能发生氧化还原反应。除此之外,还有浓度、溶液酸碱性、温度、催化剂等外在因素对物质氧化性、还原性起影响作用。
4.浓度对物质氧化性、还原性的影响:
一般说来,溶液浓度越高,溶质的氧化、还原性就越强。制氯气反应中,若盐酸浓度过低则反应不能进行;因浓硫酸氧化性强于稀硫酸,所以Cu可与浓硫酸发生氧化还原反应,而稀硫酸则不能;再如Ag+与I-浓度较大时,发生氧化还原反应:Ag++2I-=2Ag+I2,浓度较小时发生复分解反应:Ag++I-=2AgI↓。另外,氧化剂、还原剂浓度会使氧化还原产物有所不同,如稀硝酸还原产物一般是NO气体,浓硝酸还原产物则是NO2。
5.温度对物质氧化性、还原性的影响:
一般说来,物质所受温度越高,氧化还原性就越强。有些氧化还原反应在常温下或低温下不发生反应,只有达到一定温度时才能反应。如碳随温度升高还原性增强,几乎能还原所有金属氧化物。另外,温度变化,因氧化、还原性随之发生变化,产物也发生变化,如NH4NO3所受温度越高,爆炸越剧裂,产物越复杂。
6.溶液酸碱性对氧化、还原性影响:
酸性条件能增强氧化剂氧化能力,并有利于归中反应,中性、碱性条件下会使氧化剂能力变弱,并有利于歧化反应的发生。如酸化的KMnO4溶液氧化能力远大于碱性的KMnO4,其还原产物也不同。在酸性介质中MnO4-被还原成近乎无色的Mn2+(淡粉红色);碱性介质中,MnO4-被还原成MnO42-;中性介质中,MnO4-被还原成MnO2。又如:Cl2通入水或碱溶液中,发生歧化反应,而KClO3与HCl则可发生归中反应得到Cl2。
7.催化剂对物质氧化、还原性的影响
催化剂使用与否首先影响反应速率。另外,使用不同的催化剂其氧化还原产物也会不同,如:

8.高价态元素氧化性不一定强
最高价只有氧化性,但氧化性强弱还受该元素所在原子团的稳定性影响,原子团结构越稳定,物质氧化性就越弱,反之,就越强。如:H3PO4,由于PO43-结构稳定,H3PO4中P+5几乎不表现氧化性;但HNO3由于结构不稳定,而表现出强氧化性,为氧化性酸,再如氯含氧酸强弱:HClO>HClO2>HClO3>HClO4。
9.元素中间价虽即可表现氧化性又可表现还原性,但仍可成为强氧化剂
元素中间价虽即可得电子又可失电子,但得电子能力仍可很强。如Na2O2(或H2O2)中O-1为氧元素中间价,在反应中可同时表现氧化性及还原性,但Na2O2由于反应中可释放出氧原子,所以是强氧化剂。
10.物质氧化性及还原性受状态影响
物质氧化性及还原性受固态、液态、气态影响,状态不同氧化、还原性也不同。一般来说,固液态氧化、还原性大于气态。另外,溶液中的氧化、还原性与纯净物又有所不同,如水溶液中还原性SN>Pb,而气态金属还原性是Pb>SN,氧化性:CO2大于溶液中CO32-。
11.元素氧化、还原性与单质氧化还原性不一定一致
发生化学反应时首先破坏单质中的化学键,消耗能量,然后元素原子再进一步结合形成新物质。消耗能量的多少对元素性质起一定制约作用,如N2因结构中有三个共价键,键能大,发生化学反应时首先需破坏三个共价键而消耗较大能量,所以N2在常温下不活泼,但当N2变为n(元素时),因n(元素原子半径小)、最外层电子数较多,故呈现出活泼的非金属性。
12.物质氧化还原性受结构影响
许多物质虽然元素价态一样,但性质不尽相同。如CuS可被硝酸氧化,而Ag2S却不能,原因是Ag2S晶体结构与CuS不同,Ag2S结构较为紧密导致S-2不被氧化。在乙醛的氧化实验中,选用新制Cu2(OH)2原因是新制状态下结构疏松氧化性强,而久置的结构紧密氧化性差。另如,工业合成氨中选用的催化剂为还原性铁粉:α-Fe,晶体铁有三种晶型,只α-Fe有还原性称还原铁粉。在Al2O3性质实验中,也经常出现因所取Al2O3晶型不同而导致实验失败。
三、物质氧化性、还原性大小比较规律
13、根据方程式判断:
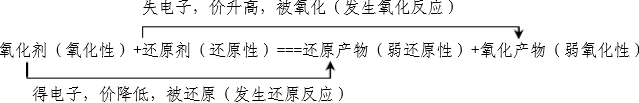
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
14、根据物质活动性顺序比较判断:
①金属活动性顺序(常见元素)

②非金属活动性顺序(常见元素)

15、根据反应条件判断:
当不同的氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的高、低来进行判断。例如:16HCl+2KMnO4====2KCl+2MnCl2+8H2O+5Cl2↑①
4HCl+MnO2====MnCl2+2H2O+Cl2↑②
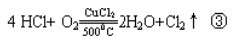
上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4、MnO2、O2,①式中KMnO4常温时可把浓盐酸中的氯离子氧化成氯原子。②式中MnO2需要在加热条件下才能完成,③式中O2不仅需要加热,而且还需要CuCl2做催化剂才能完成。由此我们可以得出结论:
氧化性:KMnO4>MnO2>O2
16、根据氧化产物的价态高低判断:
当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。
如:2Fe+3Cl2![]() 2FeCl3Fe+S
2FeCl3Fe+S![]() FeS可以判断氧化性:Cl2>S
FeS可以判断氧化性:Cl2>S
17、根据元素周期表判断:
①同主族元素(从上到下)
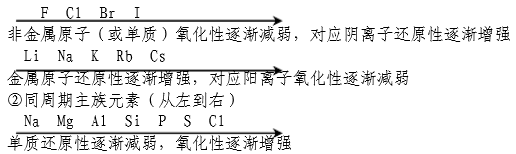
18、根据元素最高价氧化物的水化物酸碱性强弱比较:
例如:酸性:HClO4>H2SO4>H3PO4>H2CO3,可判断氧化性:Cl>S>P>C
19、根据原电池、电解池的电极反应比较判断:
①两种不同的金属构成原电池的两极。负极金属是电子流出的极,正极金属是电子流入的极。其还原性:负极>正极
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
20、根据物质的浓度大小比较判断:
具有氧化性(或还原性)的物质的浓度越大,其氧化性(或还原性)越强,反之,其氧化性(或还原性)越弱。如:氧化性:HNO3(浓)>HNO3(稀)。
四、氧化、还原能力大小比较中几个不一定
21.同一元素在不同价态时,价态越高,氧化能力不一定越强。
如在含氧酸中,由于受酸分子内部结构的影响,许多含氧酸的中心原子(除O、H以外的原子)价态越高,氧化能力越弱。如氧化能力:H2SO3〉稀H2SO4(H2SO3能氧化H2S,而稀H2SO4不能),HClO>稀HClO4(HClO有较强的氧化漂白能力,而稀HClO4没有)。
22.不能简单地从还原或氧化的程度大小,来判断物质的氧化或还原能力。
得或失电子的难易程度决定着物质的氧化或还原能力。如Cl2得电子能力强于S。Cl2和S同样在加热条件下分别与Fe反应时,Cl2能将Fe氧化到+3价生成FeCl3,而S只能将Fe氧化到+2价生成FeS,体现了氧化能力:Cl2>S。
但在Cu分别与浓、稀HNO3的反应中,浓HNO3被还原成NO2,稀HNO3被还原成NO,n(的化合价下降数是稀)HNO3大于浓HNO3,体现稀HNO3被还原的程度大于浓HNO3,而事实上浓HNO3的氧化能力远大于稀HNO3。
23.判断氧化剂的氧化能力,不能简单地看氧化剂被还原成的价态高低,而应看氧化剂氧化其它物质的能力。
如硝酸越稀,氧化能力越弱,跟同一还原剂反应时,化合价降得越多,得产物价态越低。而KMnO4溶液的酸性越强,氧化能力越强,跟同一还原剂反应时,化合价降得越多,得产物元素价态越低。如:
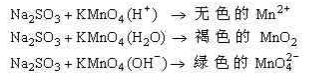
24.氧化还原反应中,氧化剂的氧化能力强于氧化产物,还原剂的还原能力强于还原产物,但也有它的特殊性。
如:
这个反应发生的原因,是由于有气体产生,并及时离开反应体系,浓度减小,平衡正移,使反应顺利进行。

- 全部评论(0)
