无机反应关系(八圈图)的用途
时间:2007-03-25 13:09 来源: 作者:唐艳玲 点击:次 所属专题: 化学反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
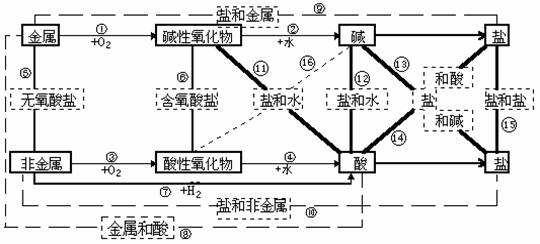
表 物质反应的相互关系表
物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!
无机物的相互关系表(即八圈图)有以下五个用途:
(1) 表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;
例1:完成下列反应:
① Mg ® MgO ®MgCl2 ® Mg(OH)2 ® MgSO4
② C ® CO2 ® CaCO3 ® Ca(HCO3)2 ® CaCO3 ® CO2
(2) 表示16个基本反应规律;
⑴ 金属+氧气 ® 碱性氧化物
⑵ 碱性氧化物+水 ® 碱
⑶ 非金属+氧气 ® 酸性氧化物
⑷ 酸性氧化物+水 ® 含氧酸
⑸ 金属+非金属 ® 无氧酸盐
⑹ 酸性氧化物+碱性氧化物 ® 含氧酸
⑺ 非金属+氧气 ® 酸
⑻ 金属+酸 ® 盐+氢气
⑼ 金属+盐 ® 盐+金属
⑽ 非金属+盐 ® 盐+非金属
⑾ 酸+碱性氧化物 ® 盐+水
⑿ 酸+碱 ® 盐+水
⒀ 碱+盐 ® 盐+碱
⒁ 酸+盐 ® 盐+酸
⒂ 盐+盐 ® 盐+盐
⒃ 碱+酸性氧化物 ® 盐+水
(3) 表示物质的性质;
例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4) 表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;![]() —
—![]() 表示复分解反应;化合反应能逆向进行的就是分解反应;
表示复分解反应;化合反应能逆向进行的就是分解反应;
(5) 表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。
例2:写出能生成ZnCl2的六种化学反应方程式。
解析:很多学生在解此题时,存在的问题有两个,一是思维无绪,解题无据,不知道本题应按照八圈图从左到右地去考虑,而是想到一种写一种;二是把题目中的六种当成六个化学方程式来写。实际上,六种反应写出的化学方程式肯定不了六个。
例3:试举一个无机物例子以实现下列变化,并写出各步化学方程式。
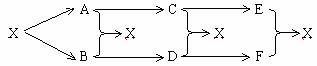
解析:本题实质上是考八圈图,穿其中的大动脉是盐。可举NaCl、CaCO3等。
在中学化学中,八圈图不能包括的其它反应规律还有:
① 碳酸(氢)盐的分解
② 碳酸(氢)盐+酸
③ 铜与浓、稀硝酸、浓硫酸的反应
④ 硝酸盐的分解
⑤ 铵盐与碱反应
⑥ 不溶性碱的热分解
⑦ 酸式盐与正盐的互变规律
⑧ 盐类水解规律
⑨ 非金属与强碱溶液生成两种盐与水
例4:从铜怎样制取氢氧化铜?
解析:有的人会写出如下化学方程式:2Cu+O2![]() 2CuO,CuO+H2O=Cu(OH)2,显然后一个化学方程式错了,这也是学生常犯的错误。正确的是:CuO+2HCl=CuCl2+H2O,CuCl2+2NaOH=2NaCl+Cu(OH)2¯。
2CuO,CuO+H2O=Cu(OH)2,显然后一个化学方程式错了,这也是学生常犯的错误。正确的是:CuO+2HCl=CuCl2+H2O,CuCl2+2NaOH=2NaCl+Cu(OH)2¯。
为什么按照反应规律写出的化学方程式不正确呢,这是因为反应规律不是绝对的,很多反应规律都有条件限制。
(1) 强强易,弱弱难,不强不弱居中间。
① 酸+碱
② 氧化剂+还原剂
③ 酸+碱性氧化物
④ 碱+酸性氧化物
⑤ 酸性氧化物+碱性氧化物
⑥ 金属+非金属
(2) 溶易,不溶难。
① 碱性氧化物+水
② 酸性氧化物+水
(3) 弱弱易、强强难。
① 盐类水解
② 非金属+非金属
(4) 复分解反应
酸、碱强度不太弱,中和成水能发生。
两个界线:Al(OH)3+H2CO3≠,H3AlO3+NH3·H2O≠。
酸盐反应酸要溶,强代弱来稳代分;难挥发代易挥发,盐若沉淀也发生。
例外:CuSO4+H2S=CuS+H2SO4
AgCl+HNO3≠,BaSO4+HNO3≠,BaSO4+HCl≠,
盐盐、盐碱皆要溶,生成沉淀才发生。
盐(溶)+碱(溶)=盐¯+碱,或:盐(溶)+碱(溶)=盐¯+碱¯
盐(溶)+盐(溶)=盐¯+盐
(5) 置换反应溶或熔,活动顺序强代弱。
下面问题可供练习:
问题:怎样实现下列反应(要求各举一例),写出有关化学方程式。
① 由可溶性的盐制不溶性的碱
② 由不溶性的碱制可溶性的盐
③ 由不挥发性的酸制备挥发性的酸
④ 由稳定性的酸制备不稳定性的酸
⑤ 由强酸制弱酸
⑥ 由可溶性碱制备不溶性碱
⑦ 由强碱制弱碱

- 全部评论(0)
