应用结构化学知识解决中学有机化学的几个小问题
时间:2022-08-12 16:12 来源:未知 作者:何清松 点击:次 所属专题: 有机化学基础
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
为什么CH4是正四面体结构?为什么烷烃分子中 的碳链是折线形的?苯环中介于单键和双键之间的键 究竟是怎么回事?有机物中怎么找相邻原子间的正负 性?等等,这些都是学生在中学化学学习过程中提出的 各种各样的疑问。如何更好地解释清楚这些疑问呢? 这就需要从结构化学的角度来进行分析。
人教版选修5《有机化学基础》教材中并未对以上 疑问做出具体的解释,而选修2《物质结构与性质》则能 详细阐述,这本教材通常作为有兴趣的学生选修,但大 多数北京市普通高中因为高考压力、课时压力等原因没 有机会接触这门课程。笔者尝试在教学过程中应用相 关的结构化学知识答疑解惑,期间发现其实适当运用结 构化学知识更能将一些中学疑难问题解释清晰并简化, 且在学生解高考题中也有一定的实际应用,并且能帮助 学生站在更髙层次上来理解事物内在的本质,同时也收 到了较好的教学效果。
现就学生常见两类理论性知识进行详细的解释 如下。
一、应用吸电子作用和推电子作用解释中学有机反应中加成与取代反应
1.应用吸电子作用和推电子作用解释加成反应
在氯乙烷的碳氯键中,因为氯元素的电负性大于碳 元素的电负性,共用电子对就会偏向氯原子而使碳氯键 产生极性,这样就会使得氯原子显负电性,而相连接的碳原子显正电性。
与氯原子相反,有些基团在分子中会表现出推电子作用。例如,丙烯分子中,甲基是具有推电子性能的基团,对碳碳双键会产生推电子作用,最终使得双键碳原子间的一对共用电子偏向双键中的链端碳原子,使其呈现负电性,而相邻碳原子呈现正电性。
这就很好地解释了学生提出的如何判断有机物中相邻原子间的正负电性问题。
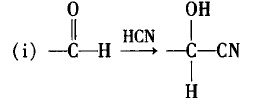
这一内容的解释能帮助学生更好地理解一些双键 加成的问题。例如,丙烯与HCl的加成,因为推电子作 用使得链端C原子显负电性,依据异性相吸原理更易吸 引HCl分子中显正电性的H原子,所以二者加成的主要 产物为2-氯丙烷。再比如乙醛与HCN加成,因为醛基 中碳氧双键中的氧原子吸电子作用使得O原子显负电 性,碳原子显正电性。因此有如下反应:
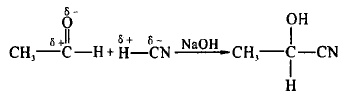
所以加成反应的结果是:双键或三键两端带部分正电荷的原子与试剂中带部分负电荷的原子或原子团结合,双键或三键两端带部分负电荷的原子与试剂中带部 分正电荷的原子或原子团结合,生成反应产物。
2013年普通高考(北京卷)理综25题新信息(I)直 接应用了该理论。
2.应用吸电子作用和推电子作用解释取代反应
对于取代反应也是这样,只要有机物分子中有极性 单键,该有机化合物就能发生取代反应。以乙醇与氢溴 酸发生的取代反应为例:
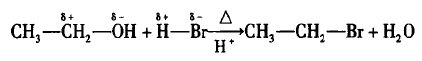
乙醇分子中有带部分正电荷的乙基部分与氢溴酸 分子中带部分负电荷的溴原子结合生成溴乙烷分子,而 乙醇分子中带部分负电荷的羟基部分与氢溴酸分子中 带部分正电荷的氢原子结合生成水分子。
所以,炔烃、醛、酮、竣酸等分子中的烷基部分也能 发生取代反应’其中与官能团直接相连的碳原子(α-C)上 的碳氢键最容易发生断裂,即与饱和α-C相连的氢原子 α-H)容易被取代。
例如:
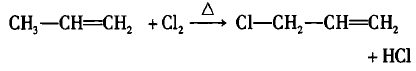
2009年普通高考(北京卷)理综28题由丙烯到A即是对上述理论的考查’当然通过分析题目信息也可以得出结论,只是如果对取代理论的本质更加清晰的话是可以很快得出取代反应的结论。
同样,2012年普通高考(北京卷)理综28题的新信息提到 (R为烷基,X为卤原子),其实应用上述理论解释就非常好理 解了。
(R为烷基,X为卤原子),其实应用上述理论解释就非常好理 解了。

说白了,就是显负电性的苯基更易吸引带正电性的 R基,形成新的有机物 ,同时生成HX。
,同时生成HX。
从以上北京高考有机题目的新信息应用中发现,如 果给予学生适当的结构化学知识,不仅能让学生快速理 解信息的本质,达到更准确解答题目和更节约时间的目 的,也能让学生从更高层次来理解有机物之间发生反应 的本质,从而进一步提高学生理解和分析问题的能力。
3.应用吸电子作用和推电子作用解释水比醇与活泼金属的反应剧烈程度问题
醇分子中,与羟基直接相连的碳原子上的烃基越 多,推电子作用越强,氢氧键的极性就越弱,则羟基氢原 子就越不活泼。
而氢原子的推电子作用比烃基弱,水分子中由于没 有推电子烃基的影响,氢氧键极性比较强,也因此使得 水分子中经基氢原子更活泼,易于断键发生反应。
所以水与活泼金属的反应较醇与活泼金属的反应 更为剧烈。
二、应用原子轨道理论解释中学典型有机物的基本结构
1.应用原子轨道理论解释甲烷分子的空间构型
大家都知道甲烷分子的空间构型为正四面体形,中 心碳原子与四个氢原子形成四个碳氢单键,任意两个键 之间的夹角均为109°28'。而经研究证实,其他烷烃分 子中碳原子的成键方式都与甲烷分子中的碳原子相似, 碳原子周围的四个单键,无论是碳碳单键还是碳氢单 键,任意两个键间的夹角都接近109°28'。正因为如此, 这些烷烃分子中的碳链是折线形的。
我们通过大学化学的系统学习,很容易理解这样的 讲述。但是学生从没有接触过量子力学的知识,就很容易产生这样的疑问:碳原子最外层是四个电子,我能理解成四键为饱和,但为什么说甲烷的空间构型是正四面体,而不是正方形结构呢?
这要如何解释呢?还是要从本质揭示原因?这就 离不开结构化学的知识。
量子力学用原子轨道描述核外电子的空间运动状 态,碳原子最外电子层的四个原子轨道如图1所示:
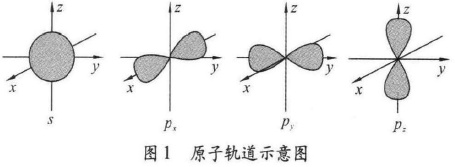
碳原子与其他原子成键时,这些轨道会全部或部分 发生被称作杂化的变化,形成一组彼此间能量相同,与 原轨道数目相等的新轨道——杂化轨道。当成键后的 碳原子为饱和碳原子时,成键时上述四个轨道全部参加 杂化,杂化后形成的四个新轨道是四个空间伸展方向完 全对称的杂化轨道,如图2所示。
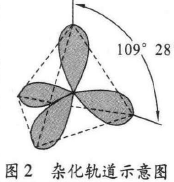
共价键是通过原子轨道的重 叠形成的。甲烷分子中碳原子的 四个杂化轨道分别与氢原子的原 子轨道重叠,形成了空间构型为 正四面体形的分子。
这样简化解释后,学生才明 白原来原子核外电子并不像初中讲授时所画的原子结 构图那样一层一层由内而外的简单排布,而是有一定的 立体空间运动轨迹。这样,就更好地理解了自己提出的 问题。
这样适当地引入一些结构化学知识,不但帮助学生 更加清楚理解了事物的本质,也让他们站在更高层次来 学习现有的知识。
2.应用原子轨道理论解释苯分子中特殊的化学键
同样,原子轨道理论也解释了学生提出的苯环中介 于双键与单键之间的特殊键究竟是什么样特殊的键的 问题。
原子轨道重叠成键的方式通常有两种:一种是沿着 键轴“头碰头”重叠形成的键,叫做σ键;另一种是“肩并 肩”重叠形成的键,叫做π键,如图3所示。
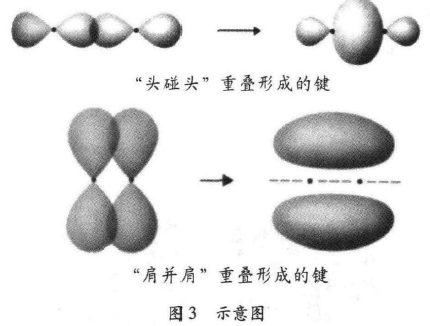
因为σ键的重叠程度大于π键,所以键能通常较 高,比较稳定。两个碳原子形成双键或巻键时,受轨道在空间伸展方向的限制,若一对成键轨道以“头碰头”的方 式重叠,那么其他轨道就只能以“肩并肩”的方式重叠, 即双键和畚键中只能有一个是σ键,其余的都是π键。
苯分子是平面形分子,每个碳原子通过σ键结合成 正六边形的碳环,每个碳原子通过σ键分别与一个氢原 子结合,六个碳原子和六个氢原子处于同一平面。每个 碳原子还有一个空间伸展方向垂直于该平面的原子轨 道,其中各有一个电子。这六个轨道“肩并肩”重叠后形 成一个特殊的共价键,六个电子被六个碳原子共用,这 样的键叫做大π键。大π键的存在,使得苯较为特殊 (如图4所示)。
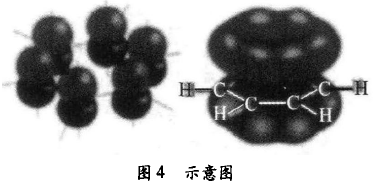
到此,学生真正认清了苯分子的特殊结构。
当然,这样的“解释”我们通常放在课下与一些有能 力、有兴趣的学生探讨,扩展他们的思维,开阔他们的眼 界与思路。而这些学生反映这样的探讨不论是对后续 的学习,还是对高考都有很大的帮助和意义。甚至有一 部分学生因此对化学知识产生想要深入了解的想法,在 报考中选择了与化学相关的专业。
因此,笔者认为在中学化学学习阶段适当地应用结 构化学知识来解疑答惑,不仅可以帮助学生从根本上解 答疑问,更可以培养学生以严谨、科学的态度对待问题。 笔者也希望广大中学化学教师能更多地推广结构化学 知识,将结构化学作为一门真正的选修课程开展下去。

- 全部评论(0)
