浅谈次氯酸根离子的氧化性
时间:2016-03-09 20:24 来源: 作者:樊会武 点击:次 所属专题: 次氯酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近几年,全国高考化学试卷中有关ClO-的知识点曾经几次出现,所占分值为:1992年9分,1993年2分,1994年8分,1996年3分。一个“不起眼”的知识点高考如此重视,令人深思。其中,有代表性的是1992年、1994年、1996年三年高考试卷中的三道相关试题。
一、相关例题
例1 (1992年第29题)将氯气用导气管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现,这是因为通气后混合液中产生的ClO-被还原发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,……根据需要填写下列空白:……(4)实验时,仪器①中除观察到红光外还有_____现象,……(6)实验时仪器①中ClO-与H2O2反应的离子方程式是_____。(题中与本文无关部分已略去)。
分析 此题主要考查了Cl2与NaOH反应生成的NaClO继续与H2O2反应的有关知识,其中特别考查NaClO在碱性条件下,有很强的氧化性,能够将H2O2氧化生成O2的同时放出红光,反应的离子方程式为:ClO-+H2O2==Cl-+O2↑+H2O
例2 (1994年第32题)下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去)。
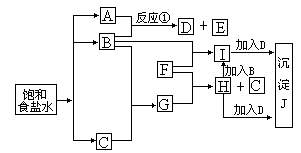
请填写下列空白:
(1)物质B是____,F是____,J是____;
(2)反应①的离子方程式是________。
分析 根据框图不难推得B是Cl2、D是NAClO;从H中加入b生成I,并结合在H或I中加入D均生成沉淀J分析出F是Fe,沉淀J为Fe(OH)3。但一般考生因不熟悉ClO-的氧化性及ClO-能与Fe3+发生双水解反应的性质,而使本题成为难攻的堡垒。I中加入D发生的离子反应方程式为:Fe3++3ClO-+3H2O==Fe(OH)3↓+3HClO
H中加入D发生的离子反应方程式为:6Fe2++3ClO-+3H2O==2Fe(OH)3↓+3Cl-+4Fe3+
例3 (1996年第11题)下列各组离子,在强碱性溶液中可以大量共存的是 [ ]
![]()
![]()
![]()
D.K+、Na+、ClO-、S2-
分析 此题A、B、C三组都易于作答,在D组中,因部分考生认为ClO-只在酸性条件下才具有强氧化性,在强碱性条件下氧化能力较弱,不能氧化S2-。这样,相当多的考生都认为D组离子在强碱性溶液中可以大量共存而误选。ClO-与S2-反应的离子方程式为:ClO-+S2-+H2O==Cl-+S↓+2OH-
纵观以上三题考生思维受阻的原因,都是不清楚ClO-在碱性条件下具有较强的氧化性。确实,在无机化合物中有许多离子在强酸性条件下,![]()
![]()
![]() 些离子共存。下面从电极电势的角度对有关物质在碱性条件下的氧化性问题加以说明。
些离子共存。下面从电极电势的角度对有关物质在碱性条件下的氧化性问题加以说明。
二、部分离子对在碱性条件下的标准电极电势
碱性条件下的标准电极电势(单位:V):
1.XO-+2e-+H2O==X-+2OH-
(X为Cl、Br、I)
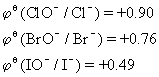
2.Fe(OH)3+e-==Fe(OH)2+OH-
![]()
![]()
![]()
4.H2O2+2e-==2OH-
![]()
5.S+2e-==S2-
![]()
6.O2+4e-+2H2O==4OH-
![]()
![]()
![]()
在标准电极电势表中,数据越大,表示电对中氧化型微粒的氧化性越强,还原型微粒的还原性越弱;数据越小,则电对中还原型微粒的还原性越强,氧化型微粒的氧化性越弱。发生氧化还原反应时,总是两电对中较强的氧化型微粒和较强的还原型微粒发生反应,生成较弱的还原型微粒和较弱的氧化型微粒。
三、由电极电势分析各粒子氧化性的强弱顺序
![]()
![]()
![]()
强碱性混合溶液中,H2O2不但不能将Cl-氧化,反而被ClO-氧化,ClO-与H2O2反应的离子方程式为:ClO-+H2O2=Cl-+O2+H2O
![]()
![]() 能将S2-氧化成S。
能将S2-氧化成S。
![]() 在空气中易于被氧化而出现浑浊。
在空气中易于被氧化而出现浑浊。
![]() 条件下,BrO-、IO-同样具有较强的氧化性,能氧化Fe2+、
条件下,BrO-、IO-同样具有较强的氧化性,能氧化Fe2+、![]()
3BrO-+6Fe2++3H2O==3Br-+2Fe(OH)3↓+4Fe3+
3IO-+6Fe2++3H2O==3I-+2Fe(OH)3↓+4Fe3+
BrO-S2-+H2O==Br-+S↓+2OH-
IO-S2-+H2O==I-+S↓+2OH-
![]()
![]()
四、对以往高考题中出现有关ClO-知识点的分析
从上述三年高考试题还可以看出,考查ClO-的氧化性是一个循序渐进的过程。1992年第29题,是首次考查ClO-的氧化性,因而以信息给予题形式出现,题目给出了Cl2通入较浓的NaOH和H2O2的混合液中,产生的ClO-能被还原,生成O2并放出红光。这样就为书写ClO-与H2O2反应的离子方程式做了知识上的准备,这样即使考生不了解ClO-有无氧化性,只要认真读懂原题,解答此题应该是没有多大问题的。1994年第32题以框图题出现,考生推断就不那么轻松了,尽管如此,题目还是为考生设计了台阶,引导考生思考,分别给出了I中加入D生成沉淀J,H中加入D也生成沉淀J,这样就给考生推断提供了条件,不过此题与1992年第29题相比,条件已隐含了许多。1996年第11题就在前几年考查的基础上不作任何提示,以离子共存问题的形式,考查了ClO-与S2-的反应。如果仅从这一题看,似乎有些突然,而从整个高考试题演变的进程看就不难理解高考命题人的良苦用心了。
那么,关于ClO-的性质在教材、大纲及考试说明中是怎样要求的呢?在高中化学(必修本)第一册中,讲到用漂白粉漂白时有次氯酸钙跟稀酸或空气里的二氧化碳和水蒸气反应生成次氯酸。文中之意是漂白粉之所以能够漂白,是因为漂白粉能与酸反应生成次氯酸的缘故,这样就会使人误以为ClO-只有在酸性条件下才能表现出强氧化性。而在《化学教学大纲》中只提到“漂白粉”三个字,这也难以让人引伸到ClO-本身具有较强的氧化性。而在化学科《考试说明》中,要求考生要了解HClO(次氯酸)的重要性质和用途,并掌握漂白粉的组成、性质和用途,这中间当然包括要掌握ClO-的有关性质,如ClO-能与酸性比次氯酸强的酸反应、ClO-的水解反应、ClO-的氧化性等。因此,在教学过程中,一定要手中抓住现行课本,眼睛盯着教学大纲,心里装着考试说明,头脑中不断研究历届高考试题,只有这样,才能真正把握教学的分寸,提高课堂教学的效率。
依笔者分析,Na2O2及H2O2的氧化性也应引起我们的重视。《考试说明》要求以Na2O2为例了解过氧化物的性质,Na2O2放入水中会生成NaOH和H2O2,因而Na2O2在水溶液中的强氧化性实际是由H2O2表现出来的。H2O2在酸性条件下的电极反应及标准电极电势为:H2O2+2e-+2H+==2H2O ![]()
H2O2在碱性条件下的电极反应及标准电极电势为:H2O2+2e-==2OH- ![]()
从标准电极电势的数值看,H2O2不管在酸性还是碱性条件下都有较强的氧化性,能够氧化许多物质。特别是H2O2在酸性溶液中的还原产物是H2O2,在碱性溶液中的还原产物是OH-,在反应过程中不带入新的物质。因此,
H2O2可能会以一种适用范围广、无污染的强氧化剂出现在试题中。

- 全部评论(0)
crystal(2805976791) 评论 浅谈次氯酸根离子的氧化性:大大的分析太棒了 很感谢您!! 希望以后作品越来越好!!
