概念辨析:几组容易混淆的化学概念
时间:2016-01-08 13:32 来源:未知 作者:李萍 点击: 次 所属专题: 概念辨析
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
准确理解化学概念,是学好化学必需的基本功之一。本书将一些容易混淆的化学概念进行对比,以帮助读者理解它们的正确含义和相互之间的区别。
1.“性质”与“变化”
“性质”与“变化”是两个不同的概念。“性质”是物质具有的特征,“变化”是物质的某种运动过程。但“性质”与“变化”是密切相关的,物质能发生“变化”是由物质的“性质”决定的;“变化”则是物质“性质”的反映。在叙述物质的“性质”时,往往有“能”、“会”、“可以”等字眼。
在判别物质的物理变化和化学变化时,根本的区别在于有没有新物质生成。在判别有无新物质生成时,切不可只看表面现象,更重要的是要看化学成分有否改变。[来源:Zxxk.Com]
2.“原子的质量”、“相对原子质量”和“原子质量数”
“原子的质量”是指一个原子的实际质量,以千克作单位。如原子核内有6个质子和6个中子的碳原子质量为1.992×10-26kg;原子核内有8个质子和8个中子的氧原子质量为2.657×10-![]() 26kg。这样小的数字对书写、记忆和运算都不方便,就好比一粒芝麻的质量用吨作单位,得到一个非常小的数字一样。
26kg。这样小的数字对书写、记忆和运算都不方便,就好比一粒芝麻的质量用吨作单位,得到一个非常小的数字一样。
“相对原子质量”是以一个12C原子质量的1/12(约为![]() 1.6606×10-27kg)作标准,其他原子的质量跟该标准相比较,得到的比值为该原子的相对原子质量。
1.6606×10-27kg)作标准,其他原子的质量跟该标准相比较,得到的比值为该原子的相对原子质量。
“原子质量数”是原子的近似相对原子质量,等于这个原子核内质子数和中子数之和。原子质量数是整数。
3.“组成”和“构成”
“组成”用于从宏观角度来说明物质,“构成”用于从微观角度来说明物质。
如:水是由氢元素和氧元素组成(宏观);1个水分子是由2个氢原子和1个氧原子构成(微观)。
又如:由同种元素组成的物质叫单质(宏观);由同种分子构成的物质叫纯净物(微观)。
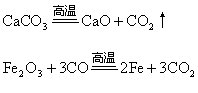
4.“加热”和“高温”
“加热”和“高温”都是反应条件,一般所说的“加热”是指用酒精灯加热所产生的温度条件(500℃以下)。如反应所需的温度超过酒精灯所能提供的温度,这时的反应条件就是“高温”,可使用酒精喷灯或煤气灯加热。酒精喷灯或煤气灯![]() 加热的温度可达700~1000℃,这就是通常所说的“高温”。
加热的温度可达700~1000℃,这就是通常所说的“高温”。
“加热”与“高温”不仅有量的差别,有时还具有质的区别。有的反应只有在“高温”条件下才能发生,在一般“加热”条件下反应则不能进行。
如:
5.“洁净物”和“纯净物”
“洁净物”是指根据一定需要认为清洁的物质,主要是指细菌及其他有害的物质减少到无害的程度,如洁净的空气、洁净的水。在洁净空气中有O2、N2等成分;在洁净的水如矿泉水中,除水以外还有各种人体需要的矿物质,因此洁净物不一定是纯净物。
“纯净物”是指由一种分子构成的物质,如氧气、氯酸钾等,化学研究的对象主要是纯净物。
必须指出,世界上没有绝对纯净的物质。如24K黄金含金量达到99.99%,对这种纯度极高的物质,所含杂质对其性质不会产生明显的影响,通常把它看作纯净物。
6.“白色”和“无色”
在填写实验报告时,常分不清白色和无色,把无色写成白色。其实“白色”是固态物质对各种波长的光线全部反射时所呈现的颜色,如白色固体,而“无色”则是物体使各种波长的光线全部透过时的颜色,如无色溶液、无色固体等。
7.“烟”和“雾”
“烟”是固体微粒分散在空气中形成的分散系,如磷燃烧时因为生成五氧化二磷细小固体,所以在空气中形成白烟;铜在氯气中燃烧,形成氯化铜细小固体而形成棕色烟。
“雾”则是液体的微小液滴分散在空气中形成的分散系。如装浓盐酸的瓶口出现白雾,实际上是从浓盐酸中挥发出来的氯化氢气体,溶解在空气的水蒸气中形成细小的盐酸液滴。磷在氯气中燃烧,因为生成液态的三氯化磷和固态的五氯化磷,因此产生白色的烟雾。
8.“溶解性”和“溶解度”
“溶解性”和“溶解度”之间既有联系又有区别。“溶解性”是物质的一种物理性质,是表示物质在某溶剂中溶解能力的大小。通常用易溶、可溶、微溶、难溶等来表示。
“溶解度”是物质在一定温度、一定溶剂中溶解性大小的定量表示方法。讲溶解度时,离不开“温度”、“100g溶剂”、“饱和状态”这三个要素。
“溶解性”和“溶解度”之间是有联系的,通常把20℃时溶解度在10g以上的叫易溶物质;溶解度在1~10g之间的叫可溶物质;溶解度在1~0.01g之间的叫微溶物质;溶解度小于0.01g的叫难溶物质。[来源:学|科|网]
9.“干馏”和“分馏”[来源:Zxxk.Com]
“分馏”和“干馏”有着本质的区别。“分馏”是利用液体沸点不同达到分离和提纯液体混合物的操作,是物理变化。而干馏则是将物质隔绝空气加强热的操作,是化学变化,有新物质生成。
如,石油的分馏可得到汽油、煤油、柴油和重油;煤经过干馏则得到焦炉气、煤焦油和焦炭。
10.“鉴定”、“鉴别”和“检验”
物质的“鉴定”和“鉴别”总称为物质的检验,两者对物质检验的要求不同。
“鉴别”是根据几种物质各自所具有的特性来加以区别,确定它们是什么物质。鉴别可用物质的物理性质、化学性质或两者结合的方法。如鉴别三种白色粉末:大理石、氯化铵和碳酸钠。因为大理石难溶于水,氯化铵和碳酸钠易溶于水,可根据在水中的溶解情况把大理石鉴别出来。留下两种可根据它们的化学性质加以鉴别:如分别加盐酸,有气体放出的是碳酸钠;也可分别加氢氧化钠溶液,有刺激性气味气体放出的是氯化铵。[来源:Z.xx.k.Com][来源:学*科*网Z*X*X*K]
“鉴定”是通过化学方法确定某种物质的组成。如鉴定某种化肥是不是硫酸铵,必须通过实验证实有NH4+和SO42-的存在才能得出结论。
所以,鉴别至少是对两种以上物质加以区别,而鉴定是对某一物质的组成加以确定。
11.酸的“挥发性”和酸的“不稳定性”
酸的“挥发性”是酸的一种物理性质。如浓盐酸能挥发出氯化氢气体,氢硫酸能挥发出硫化氢气体,所以盐酸和氢硫酸是挥发性酸。[来源:学科网ZXXK]
酸的“不稳定性”则是酸的化学性质,是指酸的分子在受热或见光的条件下能发生分解反应。如碳酸分解成二氧化碳和水,亚硫酸分解成二氧化硫和水:
H2CO3=CO2↑+H2O H2SO3=SO2↑+H2O
所以,碳酸和亚硫酸都是不稳定性酸。
12.“电离”和“导电”
电解质溶解于水或受热熔化时,离解成自由移动离子的过程叫“电离”。在连接电源后能形成通路,这种现象称为“导电”。
电解质的电离与外电源无关,在没有接通电源之前,电解质已经发生了“电离”。电解质电离后离子作无规则运动,只有在接通电源的情况下,使阴、阳离子作定向运动,才能产生“导电”作用。因此,溶液导电的前提是电解质的电离。

- 全部评论(0)
