物质检验的要求和一般步骤
时间:2012-04-10 15:56 来源:未知 作者:朱照鹰 点击: 次 所属专题: 物质检验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在生产和科学研究中,常常需要对一些物质的成分进行检验,以确定其是否符合所规定的要求。针对不同的检验对象和要求,物质检验的方式、方法和步骤都有一定的差别。虽然物质检验所涉及的内容很广泛,但在中学阶段,则主要是通过某物质的一些性质对其进行检验。在本单元中,主要讨论溶液中一些常见离子的检验以及在指定范围内物质的检验。
物质检验时,虽然对不同的检验对象要使用不同的检验方法,但物质检验的一些基本要求和主要过程还是有其类同之处的。
一、进行物质检验时对反应的一般要求
对于不同的物质,对其检验时所发生反应的要求可能不同。但从总体上说,对溶液中检验常见离子的反应有以下几方面的要求。
1.反应进行的条件
(1)反应要有明显的外部特征
对于无机物来说,检验时所发生的反应大多是在水溶液中进行的离子反应。作为检验的反应,必须具有明显的外部特征,如溶液颜色的改变、沉淀的生成或溶解、气体的产生等。此外,反应还必须进行得迅速且完全,这样才有实用价值。
(2)反应要在适宜的酸碱度、浓度和温度下进行
许多检验反应都要求在一定的酸碱度下进行。例如,检验Fe3+反应如果不在酸性溶液中进行,Fe3+将发生水解,就会在一定程度上影响Fe3+检验的效果。
对物质检验的反应来说,都应有一定灵敏度的要求,而反应的灵敏度与参加反应的离子浓度有关。因此,在检验中,通常都要求反应物离子具有一定的浓度,以保证所发生的反应现象明显。特别是对于沉淀反应,不仅要求反应物离子的浓度达到能够析出沉淀的程度,而且还要求能析出足够量的沉淀,以便于观察。这一点对于溶解度比较大的物质的反应尤为重要。
溶液温度有时对物质的检验反应有较大的影响。例如,有些物质的溶解度随温度的升高而迅速增大。因此,对于有这类物质生成的检验反应来说,就不能在热溶液中进行。
另外,在室温下,有些检验反应,如某些氧化还原反应,其反应速率比较缓慢,通常就需要将溶液加热以增大它的反应速率。
除了上述三点之外,催化剂等对检验反应也会产生一定的影响。
(3)排除干扰物质的影响
在物质检验的过程中,为了保证反应的顺利进行和判断的准确性,首先应该采取适当方法以排除干扰物质。例如,用Ag+检验某溶液中是否含有Cl-时,要先向溶液中加入少量的稀硝酸,其目的就是要消除CO32-的干扰。
2.反应的选择性
一种试剂往往能与许多离子发生反应。例如,Na2CO3既能与Ca2+反应,也能与Ba2+、Ag+等反应,都生成白色的沉淀。所以,当Ca2+、Ba2+、Ag+同时存在时,用Na2CO3检验就无法判断生成的白色沉淀究竟是什么物质。因此,要求物质的检验反应要具有一定的选择性和特效性。
一种试剂如果只与少数几种离子反应,这种反应就叫做选择性反应。与该试剂反应的离子种类越少,反应的选择性越高。如果试剂只与一种离子发生反应,这个反应的选择性最高,这样的反应称为这种离子的特征反应。例如,在阳离子中,只有NH4+与强碱作用生成具有特殊性质的NH3(如有刺激性气味、能使湿润的红色石蕊试纸变蓝等),通常我们认为这个反应是NH4+的特征反应。
必须指出,在选择物质的检验反应时,应综合考虑各种因素。例如,如果仅考虑反应的选择性而忽略了离子的浓度,当被检验的离子浓度达不到要求时,检验结果往往是不正确的。反之,如果片面地强调离子的浓度而忽略反应的选择性,当有干扰离子存在时,检验也得不到可靠的结果。因此,应该在被检验离子的浓度符合要求的前提下,尽量采用选择性高的反应。
二、物质检验的基本步骤
物质检验的基本步骤如下:
1.对试样进行外观观察
在化学实验中,待检验的未知物称为试样。试样可以是固体、气体、液体。对试样的外观进行观察,可以得到一些具有参考价值的资料,以帮助我们进行判断。
试样的外观主要指试样的状态和颜色。如果试样是无色或白色的晶体,就可以排除有色物质的离子,从而大致划定可能的离子范围。如果试样有颜色,也可初步判断可能由哪种离子构成。例如,试样是蓝色晶体,就可以初步判断可能是一种铜盐;试样是一种黄色的溶液,可以初步判断在溶液中可能含有Fe3+等等。
2.试样的准备
无机物的检验反应一般都是在溶液中进行的离子反应。如果试样是固体时,首先应取少量试样配成溶液。试样溶液的配制过程,也是物质检验过程之一。在这个过程中,试样是易溶、微溶、难溶,有无浑浊物或在溶解过程中有无气体产生等,都可以作为初步判断试样大致属于哪类物质的依据。
3.检验
在检验配好的溶液中是否含有某种离子时,每次均应移取少量溶液进行检验,绝对不能将检测试剂直接加到全部待检测溶液中(为什么?)。
离子的检验
离子的检验可分为阴离子检验和阳离子检验。检验反应一般要按特征反应的要求进行,同时要认真观察反应现象。
在中学阶段,需要掌握其检验方法的离子有CO32-、SO42-、Cl-、Br-、
I-、K+、Na+、NH4+、Cu2+、Fe3+和Al3+,共11种。
表1中给出了这些离子的检验方法。
离子检验的目的,除了有针对性地检验某种离子外,更多的是检验某种物质的主要成分,即进行物质检验。
【示例】设计一个实验,证明硫酸亚铁铵晶体
【分析】证明已知物质的组成,并要进一步确认时,应利用物质中所含各组成成分的特征反应,先进行每个组分的单独鉴别,然后利用对各组分的鉴别结果确定物质的组成。
对Fe(NH4)2(SO4)2·6H2O进行外观观察。Fe(NH4)2(SO4)2·6H2O是一种淡蓝绿色晶体,说明在试样中可能有Fe2+存在。
【实验设计】
1.要确定在Fe(NH4)2(SO4)2·6H2O是否含有结晶水,可以通过加热晶体的方法进行检验。
取少量Fe(NH4)2(SO4)2·6H2O晶体放入试管中,用酒精灯加热。在试管口有液体生成,可说明在Fe(NH4)2(SO4)2·6H2O中含有结晶水。
2.检验Fe(NH4)2(SO4)2·6H2O中的其他离子时,要先将试样配成试样溶液。
取少量Fe(NH4)2(SO4)2·6H2O晶体配制试样溶液。Fe(NH4)2(SO4)2·6H2O溶解于水,溶液的颜色为淡绿色。在溶液的配制过程中,没有沉淀或气体生成。通过试样溶液的颜色,可以再次推断Fe(NH4)2(SO4)2·6H2O中含有Fe2+。
3.试样溶液配好后,就可对溶液中所含的各种离子进行分别检验了。在设计检验的程序时,要考虑离子之间的干扰。在可能有干扰存在时,要先排除干扰,然后再进行检验。
在三支试管中分别加入少量试样溶液。
向第一支试管加入浓NaOH溶液,加热,并在试管口用湿润的红色石蕊试纸检验。红色石蕊试纸变蓝,说明有NH3生成,根据这一现象可以确定在Fe(NH4)2(SO4)26H2O中含有NH4+。
向第二支试管滴入几滴用硝酸酸化的Ba(NO3)2溶液。
(3)检验Fe2+
向第三支试管滴入2滴KSCN溶液,溶液不显红色。再向这支试管中加入几滴新配制的氯水。溶液的颜色变为红色,说明有Fe3+存在。这个结果间接地说明在原溶液中有Fe2+存在(想一想:为什么?)。
这个示例的实验设计,也可以利用下图表示:
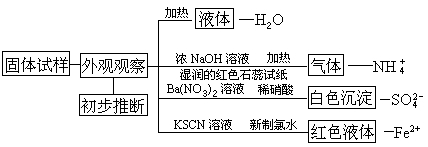
通过对Fe(NH4)2(SO4)2·6H2O中各成分检验的实例可以看出,要确认某种物质,就必须要通过阴离子和阳离子的检验。
对于一般的固体物质,通过类似的实验可以大致地确定试样中所含的成分。例如,上述实验结果只能确定该物质的组成成分,而不能确定该物质的化学式,要想确定其化学式,还要通过精确的定量实验测定,并通过计算才能确定。
未知物的检验
未知物的检验就是利用物质(或离子)的特征反应,根据实验现象检验未知物是(或有)什么,或可能是(或可能有)什么。这类问题在物质检验中经常会遇到。
【示例1】在某澄清、透明的浅黄色溶液中,可能含有下列离子:
设计一个全实验,检验溶液中存在或可能存在的离子。
【分析】对于判断溶液中存在或可能存在何种离子的问题,可根据所给的试样和实验现象进行判断。
对于本例来说,可以利用试样的颜色,首先判断在试样中存在的一种离子,并推论出一种不存在的离子。
溶液澄清、透明,为浅黄色,利用此条件可初步判断溶液中含有Fe3+。含Fe3+的溶液都是弱酸性的,以防止Fe3+的水解。而在酸性条件下HCO3-是不可能存在的。
同样,Ba2+与SO42-不能大量共存于同一溶液中。若在溶液中含有Ba2+,就不可能含有SO42-。同样,如果溶液中含有SO42-,也就不可能含有Ba2+。
【实验设计】
1.用一支洁净的铂丝蘸取少量原溶液,在酒精灯火焰上灼烧,透过蓝色的钴玻璃片观察火焰的焰色,以确定是否有K+存在。
2.用试管取少量原溶液,向试管中滴加用硝酸酸化的BaCl2溶液。如果有白色沉淀生成,说明在原溶液中含有SO42-,同时也能说明在原溶液中不含Ba2+;如果没有白色沉淀生成,说明在原溶液中不含SO42-,但无法说明在原溶液中是否含有Ba2+,仍需进一步检验。
3.若原溶液中无SO42-,可用试管取少量原溶液,向试管中滴加几滴稀硫酸,以检验是否有存在Ba2+。
4.用试管取少量原溶液。向试管滴加用硝酸酸化的AgNO3溶液,检验是否有Cl-存在。需要注意的是,如果能够确定在原溶液中没有SO42-,可以直接对Cl-进行检验;如果确定在原溶液中有SO42-存在,就必须首先排除干扰,然后再进行检验。
5.用试管取少量原溶液。滴加NaOH溶液至过量。如果在滴加NaOH溶液的过程中,先看到沉淀生成,随之部分沉淀溶解,且剩余沉淀为红褐色,说明在原溶液中含Al3+和Fe3+。同时,也可以确定在原溶液中不含HCO3-。如果在滴加NaOH溶液的过程中,只有红褐色沉淀产生,则说明在原溶液中含Fe3+,而不含Al3+。这个结果同样可以证明原溶液中不含HCO3-。
6.用试管取少量原溶液。向原溶液中加入过量浓NaOH溶液,加热。在试管口放一条湿润的红色石蕊试纸,检验是否有NH4+存在。
通过上述分析和实验,就可以推断原溶液中肯定存在何种离子和肯定不存在何种离子。
【示例2】设计一个实验,鉴别NH4NO3、K2SO4、KNO3、(NH4)2SO4四种白色固体。
【分析】鉴别物质,实际上就是利用各物质中离子的特征反应,确定每种物质是什么。对于示例中所给的四种物质,按所含的阳离子,可以分为钾盐和铵盐两大类,利用NH4+与碱在加热时放出氨气的反应,可以鉴别钾盐和铵盐;按所含的阴离子,又可以分为硝酸盐和硫酸盐两大类。可以用加入 Ba2+生成白色BaSO4沉淀的方法鉴别。根据上面的分析,可以选用Ba(OH)2作为检验这四种盐的试剂。
【实验设计】
1.将这四种白色固体编号。分别取少量试样配成溶液。
2.用四支试管分别取少量上述四种试样溶液。
3.在四支试管中分别加入Ba(OH)2溶液,并加热。
如果试管中出现白色沉淀,并放出有刺激性气味、能使湿润的红色石蕊试纸变蓝的气体,原试样为(NH4)2SO4。
如果试管中只出现白色沉淀,原试样为K2SO4。
如果试管中只生成有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝,原试样为NH4NO3。
如果试管中没有现象产生,则原试样为KNO3。
这个示例的实验设计,也可以用下图表示。
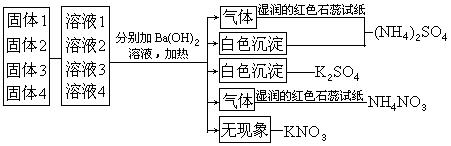
通过上述两个示例可以看出,未知物的检验也是利用离子或物质的特征反应来进行的,检验的步骤与物质检验的一般步骤基本相似。
小 结
本单元主要归纳总结了在中学化学中常见阴离子和阳离子的检验方法,并在此基础上介绍了与这些离子有关的物质的检验方法。
一、常见离子的检验方法
常见阴离子和阳离子的检验方法、反应现象和离子方程式见表1。
二、物质检验的一般要求
1.反应要有良好的选择性,反应速率要快,并能够反应完全。
2.反应要有明显的外部特征(如溶液颜色的改变、沉淀的生成或溶解、气体的生成等)。
3.要排除干扰物质的影响。
三、物质检验的基本思路和步骤
1.对试样进行外观观察
对试样进行外观观察的主要目的是利用被检验物质的颜色和状态,对可能含有的某些组分进行推断,进而排除某些组分存在的可能性。
2.试样的准备
不论是固体试样,还是液体试样,都只能取少量用于配制溶液或用于检验,要留有一定量的试样备用。
由于有些阴离子在酸性溶液中会生成气体而逸出,或发生氧化还原反应而改变价态,或与H+发生中和反应。因此,用于检验阴离子的试样通常要配成碱性,而且不能加入氧化剂或还原剂。
![]() 生水解。因此,用于检验阳离子的试样通常要配成弱酸性。
生水解。因此,用于检验阳离子的试样通常要配成弱酸性。
3.检验
在进行检验时,除了要考虑各离子的特征反应外,最重要的是要选取适当的措施排除离子之间可能存在的干扰。只要排除干扰的方法得当,就可以设计出正确的实验方案。下面几点可供选择排除干扰方法和设计具体实验步骤时参考。
(1)除少数几种阴离子以外,阴离子检验时的干扰一般比较少,有可能进行分别检验。
在检验同一试样中共存的阳离子时,相互干扰比较多。因此,在进行阳离子检验时,必须要首先排除干扰因素,然后再进行检验。
(2)在同一试样中,由于各种阴离子之间往往会发生相互反应,因此,可以共存的阴离子种类一般不会多。
在同一试样中,由于阳离子之间相互反应的可能性一般比较小,因此,可以共存的阳离子种类会比较多些。
(3)在阴离子检验中,有的阴离子可以与酸反应生成气体,因此,可以首先在固体试样上滴加稀盐酸。然后,根据气体的性质初步判断含有什么离子;有的阴离子可以与试剂反应生成沉淀,也可以利用生成沉淀时的反应条件和沉淀的颜色初步判断可能存在的阴离子,从而消除某些离子存在的可能性。
很多阳离子都带有颜色。因此,根据试样或试液的颜色,大致可以判断试样中可能含有的阳离子。在阳离子的检验中,利用有些阳离子可以发生水解,或与碱反应生成沉淀,或具有两性等特点,可以初步判断可能存在的阳离子,从而消除某些阳离子存在的可能性。
(4)焰色反应
对于像K+、Na+等阳离子,可以利用焰色反应进行检验。

- 全部评论(0)
