原电池与电解池的辨析
时间:2014-01-11 17:17 来源:未知 作者:罗翊轩 点击: 次 所属专题: 电解池 原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学常常涉及到物理学中的串联电路、并联电路以及相关的物理量,如电流强度、电压、电阻、时间、电量等,无疑,有关电化学知识也必然是物理学和化学的交汇点,这一融合正反映了“3+X”理科综合测试的精神,将会成为“3+X”理科综合测试的重点。而本专题测试的内容涉及了原电池、电解池电极判断、原理、电极产物分析、电极反应式、总反应式、电解过程的计算、电化学腐蚀、废电池回收、两池原理的应用、电解规律,学生们在学习过程中容易混淆这两个概念,在解题过程中常常出错,为了帮助学生更好的掌握原电池和电解池,对其进行了深入的辨析。
一、 装置对比:


例1:在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A、原电池的正极和电解池的阳极所发生的反应
B、原电池的正极和电解池的阴所发生的反应
C、原电池的负极和电解池的阳极所发生的反应
D、原电池的正极和电解池的阴极所发生的反应
解析:对照上图,显然选:C
| | 原电池 | 电解池 |
装置特点 | 化学能转化为电能 | 电能转化为化学能 |
形成条件 | 1、两个活泼性不同的电极 2、电解质溶液 3、形成闭合回路 | 1、两个电极 2、电解质溶液、电源 3、形成闭合回路 |
二、原理对比:
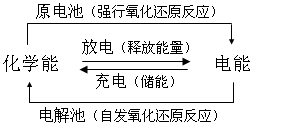
1、能量转化对比:
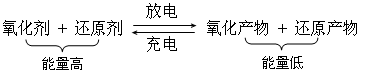
例2、有人将2Ag + 2HCl = 2AgCl + H2 ↑的反应变为现实,则下列说法正确的是( )
A、Ag粉撒入稀盐酸中
B、Ag、C作电极用导线连接插入稀盐酸中形成原电池
C、Ag、Fe作电极,用导线连接插入稀盐酸中
D、Ag接电源正极,Fe接电源负极,插入稀盐酸中
解析:Ag与稀盐酸不反应,故不能构成原电池。若发生氧化还原反应可构成电解池,Ag为活性电极,即作阳极。选:D
2、电极反应书写对比:
(1)原电池
理论上任何一个氧化还原反应发生一定有电子转移,即可行成电流,通过一定装置可构成原电池。因此,原电池的反应首先是一个自发的氧化还反应,电极反应的书写应先分析氧化还原反应中的氧化剂、还原剂、氧化产物、还原产物及电子转移数目。
负极:还原剂→失电子→被氧化→氧化产物正极:氧化剂→得电子→被还原→还原产物
例3、某电池的总反应方程式为2Fe3+ + Fe = 3Fe2+ ,不能实现该反应的原电池是( )
A、Fe为负极,Cu为正极,电解质溶液为Fe2(SO4)3
B、Zn为负极,Fe为正极,电解质溶液为FeCl3
C、Fe为负极,C为正极,电解质溶液为Fe (NO3)3
D、Fe为负极,Ag为正极,电解质溶液为CuSO4
解析:该原电池的氧化还原反应中,铁是还原剂做负极,Fe3+是氧化剂作正极,即含Fe3+的溶液作电解质。选:A 、C
例4、将Al片和Cu片用导线连接后,插入盛浓HNO3的烧杯中,下列叙述正确的是( )
A、Al比Cu活泼,Al为负极,Cu极上析出NO2
B、Cu比Al活泼,Cu为负极,Al极上析出H2
C、Cu为负极,电极反应为:Cu―2e— = Cu2—
D、Al为正极,电极反应为:2H ++ NO3—+ e—= NO2↑+ H2O
解析:Al片在浓HNO3中钝化,Cu片与浓HNO3发生氧化还原反应,Cu为还原剂做负极,失电子,浓HNO3做氧化剂得电子,Al为正极。选:D
(2)电解池
电解池是把化学能转化成电能的一种装置。有直流电源提供电流,是一种强行的氧化还原反应。电极反应的书写应先分析电极材料及电解质溶液中阴、阳离子的放电能力(放电顺序)。若阳极为金属材料,金属溶解失电子;若阳极为惰性电极,溶液中阴离子失电子。阴极是溶液中阳离子得电子。
阳极:阴离子→失电子→被氧化→氧化产物阴极:阳离子→得电子→被还原→还原产物
例5、关于电解NaCl水溶液,下列叙述正确的是 ( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
解析:电解NaCl水溶液时,阳极阴离子放电能力Cl—>OH—,2Cl—-2e—=Cl2↑,B正确;阴极阳离子放电能力H+ >Na+,2H+ + 2e—=H2↑,H+ 放电后溶液中产生OH—,阴极附近的溶液呈碱性,最终溶液呈碱性,A、C 、D错误。选:B
例6、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn + 2K2FeO4+ 8H2O  3Zn(OH)2+ 2Fe(OH)3+ 4KOH,下列叙述不正确的是( )
3Zn(OH)2+ 2Fe(OH)3+ 4KOH,下列叙述不正确的是( )
A、放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3—3e—+ 5 OH—=FeO![]() + 4H2O
+ 4H2O
C、放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
解析:可充电电池,充电时为电解池,放电时,为原电池。充电时,阳极发生氧化反应,B正确;放电时,Zn失电子参与负极反应,A正确;放电时,每转移3mol电子,正极有1mol K2FeO4被还原,C错误;放电时正极反应:FeO![]() + 4H2O + 3e—=Fe(OH)3+ 5 OH—,正极附近有OH—,D正确。选:C
+ 4H2O + 3e—=Fe(OH)3+ 5 OH—,正极附近有OH—,D正确。选:C

- 全部评论(0)
【帝(467247437) 评论 href="/plus/view.php?aid=12010">原电池与电解池的辨:错了吧 ,,原电池那个图,负失氧,正得还,,写反了
