sp2杂化轨道
时间:2013-04-13 18:00 来源:未知 作者:罗翊轩 点击:次 所属专题: 杂化轨道类型
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
同一原子内由一个ns轨道和二个np轨道发生的杂化,称为sp2杂化。杂化后组成的轨道称为sp2杂化轨道。实验测知,气态氟化硼(BF3)具有平面三角形的结构。B原子位于三角形的中心,三个B-F键是等同的,键角为120°。
基态B原子的价层电子构型为2s22p1,表面看来似乎只能形成一个共价键。但杂化轨道理论认为,成键时B原子中的一个2s电子可以被激发到一个空的2p轨道上去,使基态的B原子转变为激发态的B原子(2s12p2);与此同时,B原子的2s轨道与各填有一个电子的两个2p轨道发生sp2杂化,形成三个能量等同的sp2杂化轨道:

其中每一个sp2杂化轨道都含有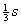 轨道和
轨道和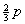 轨道的成分。sp2杂化轨道的形状和sp杂化轨道的形状类似,只是由于所含的s轨道和p轨道成分不同,在形状的“肥瘦”上有所差异。成键时以杂化轨道大的一头与F原子的成键轨道重叠而形成三个σ键,键角为120°,BF3分子中的四个原子都在同一平面上BF3是分子。
轨道的成分。sp2杂化轨道的形状和sp杂化轨道的形状类似,只是由于所含的s轨道和p轨道成分不同,在形状的“肥瘦”上有所差异。成键时以杂化轨道大的一头与F原子的成键轨道重叠而形成三个σ键,键角为120°,BF3分子中的四个原子都在同一平面上BF3是分子。
除BF3气态分子外,其它气态卤化硼分子内,B原子也是采取sp2杂化的方式成键的。
基态B原子的价层电子构型为2s22p1,表面看来似乎只能形成一个共价键。但杂化轨道理论认为,成键时B原子中的一个2s电子可以被激发到一个空的2p轨道上去,使基态的B原子转变为激发态的B原子(2s12p2);与此同时,B原子的2s轨道与各填有一个电子的两个2p轨道发生sp2杂化,形成三个能量等同的sp2杂化轨道:

其中每一个sp2杂化轨道都含有
除BF3气态分子外,其它气态卤化硼分子内,B原子也是采取sp2杂化的方式成键的。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
