离子反应方程式书写规律小结
时间:2014-01-11 16:56 来源:未知 作者:周书峰 点击: 次 所属专题: 离子方程式书写
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子反应方程式的书写是中学化学的重要知识点,为此笔者特将自己在教学实践中体会到的离子方程式的书写规律小结如下。
一、弱酸、中强酸作为反应物;弱碱出现在离子方程式中一律写成化学式。如:
1、乙酸与适量的氢氧化钠溶液反应CH3COOH+OH-=H2O+CH3COO-
2、100mL0.1mol/L的NaOH溶液与200mL0.05mol/L的磷酸溶液反
![]()
![]()
4、硫化钠溶液与盐酸反应2H++S2-=H2S↑
二、难溶于水的物质、水、气体、单质出现在离子方程式中均写成化学式。如:
![]()
2、实验室用浓盐酸和二氧化锰制氯气MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
3、锌和硫酸铜溶液反应Zn+Cu2+=Cu+Zn2+
4、钠和硫酸铜溶液反应2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑
三、微溶物如作为反应物,强调其溶解一面,按可溶物处理,写成离子符号(要注意浓度的大小,如果固体或悬浊液参加反应则写为化学式);如作为产物,强调其不溶一面写成化学式。如:
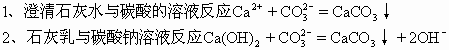
3、氯化钙溶液与氢氧化钠溶液反应Ca2++2OH-=Ca(OH)2↓
4、氢氧化钙溶液与碳酸氢钙溶液反应Ca2++2OH-+Ca2++2HCO3-=2CaCO3↓+2H2O
四、盐类水解有以下几种情况。
1、多元弱碱强酸盐的弱碱阳离子的单水解,写一级水解离子方程式,用“![]() ”符号表示,生成物是沉淀也不注“↓”符号,如Fe3++3H2O
”符号表示,生成物是沉淀也不注“↓”符号,如Fe3++3H2O![]() Fe(OH)3+3H+;NH4++H2O
Fe(OH)3+3H+;NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
2、多元弱酸强碱盐的弱酸的阴离子单水解一般只写一级水解的离子方程式,用“![]() ”符号表示,生成物中的不稳定弱酸也不写成分解产物。如:CO32-+H2O
”符号表示,生成物中的不稳定弱酸也不写成分解产物。如:CO32-+H2O![]() HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
S2-+H2O![]() Hs-+OH-。
Hs-+OH-。
3、弱酸弱碱盐的弱酸阴离子与弱碱阳离子均要发生水解的双离子水解,一般用“![]() ”符号,生成物不写沉淀符号,不稳定的弱酸或弱碱也不写成分解产物(如:醋酸铵溶于水CH3COO-+NH4++H2O
”符号,生成物不写沉淀符号,不稳定的弱酸或弱碱也不写成分解产物(如:醋酸铵溶于水CH3COO-+NH4++H2O![]() CH3COOH+NH3·H2O);但如遇双离子均强烈水解要用“=”且也要注沉淀或气体符号(如:硫化铝溶解于水Al2S3+6H2O=2Al(OH)3↓+3H2S↑)。
CH3COOH+NH3·H2O);但如遇双离子均强烈水解要用“=”且也要注沉淀或气体符号(如:硫化铝溶解于水Al2S3+6H2O=2Al(OH)3↓+3H2S↑)。
4、某些盐溶液两两混合时水解相互促进,以达到水解完全时则要用“=”符号表示,生成物也写沉淀和气体符号,不稳定酸碱分解为气体和水(如:2Al3++3CO3-+3H2O=2Al(OH)3↓+3CO2↑);但遇醋酸钠和氯化铵这种类似情况仍用“![]() ”表示(如:CH3COO-+NH4++H2O
”表示(如:CH3COO-+NH4++H2O![]() CH3COOH+NH3·H2O)且不稳定性酸碱不写成分解产物。
CH3COOH+NH3·H2O)且不稳定性酸碱不写成分解产物。
五、固体间的反应(非熔融状态)、浓硫酸和固体发生的反应,不写离子方程式,用普通的化学反应方程式表示反应的情况。如:
NaNO3(固)+H2SO4(浓)![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
![]()
六、(一般了解)络离子是相当稳定的,在水溶液中微弱电离。溶液中离子浓度很小,在写离子方程式时,只能写成络离子,不写成中心离子。如:
1、银镜反应:CH2OH(COH)4CHO+2[Ag(NH3)2]++2OH-![]()
2、硫酸铜溶液中加入过量氨水:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O。

- 全部评论(0)
