学习化学反应速率和化学平衡疑难点拨
时间:2020-12-18 15:43 来源:未知 作者:汤芹 点击: 次 所属专题: 速率与平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应速率和化学平衡一章内容是中学化学的重要基本理论,因受课本知识的深度和广度的限制,有些知识点难以透彻理解,加上概念多、理论性强,既要对问题进行定性分析,又要对问题进行定量分析,学生学习此内容感到特别难懂难学。下面,就学生在学习化学反应速率和化学平衡一章内容时在理解和运用上存在的误区进行点拨:
1.化学反应速率概念的几种提法意义是否相同
有关化学反应速率,有用单位时间反应物物质的量的变化或单位时间物质的量浓度的变化来表示,它们表示的是某段时间内的反应速率的平均值,也叫平均速率;与平均速率相对的是瞬时速率,即某一时刻的反应速率。它们是从测定的时间上分的。研究化学平衡,在可逆反应中用正反应速率、逆反应速率表示,正反应速率指可逆反应中正反应方向的反应速率,逆反应速率指可逆反应中逆反应方向的反应速率。它们是从反应方向分的。在相同条件下,几种反应速率的计算方法和数值是不同的,但存在内在联系,意义有相同之处。
2.达到化学平衡状态时,化学反应是否终止
化学平衡状态不是静止状态,它的本质特征是正反应速率和逆反应速率相等,当υ正=υ逆 时,平衡体系中各组分的百分含量保持一定,所以一般情况下平衡体系的浓度、颜色、压强、气体密度、平衡转化率等多种宏观性质也保持不变。但平衡时正、逆反应都在进行,没有终止。
3.怎样判断化学反应是否达到化学平衡状态
判断化学反应是否达到化学平衡状态,一是看本质,即正反应速率和逆反应速率是否相等;二是看平衡的外部特征,看平衡体系中各组分的百分含量是否保持一定,若平衡体系中各组分的百分含量保持一定,一般情况下平衡体系的浓度、颜色、压强、气体密度、平衡转化率、混合气体的平均分子质量等多种宏观性质也保持不变,但要具体反应、具体情况具体分析:
举例反应 | mA(g)+nB(g) | |
混合物体系中各成分的含量 | ①各物质的物质的量或各物质的物质的量分数一定 | 平衡 |
②各物质的质量或各物质的质量分数一定 | 平衡 | |
③各气体的体积或体积分数一定 | 平衡 | |
④总压强、总体积、总物质的量一定 | 不一定平衡 | |
正、逆反应速率的关系 | ①在单位时间内消耗了mmolA同时生成mmolA,即v正=v逆 | 平衡 |
②在单位时间内消耗了nmolB同时生成pmolC,均指v正 | 不一定平衡 | |
③vA:vB:vC:vD=m:n:p:q,v正不一定等于v逆 | 不一定平衡 | |
④在单位时间内生成了nmolB,同时消耗qmolD,因均指v逆 | 不一定平衡 | |
压强 | ①m+n≠p+q时,总压力一定(其他条件一定) | 平衡 |
②m+n=p+q时,总压力一定(其他条件一定) | 不一定平衡 | |
混合气体的平均分子量( | ① | 平衡 |
② | 不一定平衡 | |
温度 | 任何化学反应都伴随着能量变化,在其他条件不变的条件下,体系温度一定时 | 平衡 |
体系的密度 | 密度一定,若体系体积不变,因反应前后质量守恒 | 不一定平衡 |
4.化学反应条件改变,化学平衡是否一定移动
平衡移动就是一个“平衡状态→不平衡状态→新的平衡状态”的过程。一定条件下的平衡体系,条件改变后,平衡可能发生移动,也可能不移动。可总结如下:
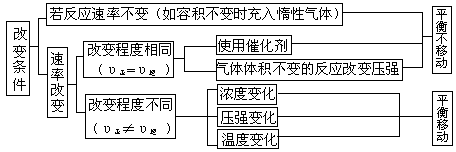
从上面的总结也可以看出,平衡是否移动,关键是看条件改变后,正、逆反应速率是否相等。若条件改变后:υ正=υ逆 ,则化学平衡不移动;υ正>υ逆 ,则化学平衡向正反应方向移动;υ正<υ逆 ,则化学平衡向逆反应方向移动。
5.如何理解勒沙持列原理
勒沙持列原理是是对化学平衡移动原理的归纳和总结,勒沙持列原理指出,如果改变影响平衡的一个条件(如浓度、压强和温度等),平衡就向着能够减弱这种改变的方向移动。其内涵是:
①影响平衡的因素只有浓度、压强、温度三种;
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。如升高温度(10℃),化学平衡向吸热反应的方向移动,使温度下降,但移动的结果不可能使体系的温度又降低10℃。其外延是勒沙持列原理又是适用于其它平衡体系(如溶解平衡、电离平衡等)的平衡移动原理。
6.平衡向正反应方向移动时,反应物转化率不一定增大
不能把平衡向正反应方向移动与反应物转化率的增大等同起来。具体分析可参考下表:
反应实例 | 条件变化与平衡移动方向 | 达新平衡后转化率变化 |
2SO2+O2 | 增大O2浓度,平衡正移 | SO2的转化率增大,O2的转化率减小 |
增大SO3浓度,平衡逆移 | 从逆反应角度看,SO3的转化率减小 | |
升高温度,平衡逆移 | SO2、O2的转化率都减小 | |
增大压强,平衡正移 | SO2、O2的转化率都增大 | |
2NO2(气) | 体积不变时,无论是加入NO2或者加入N2O4 | NO2的转化率都增大(即新平衡中N2O4的含量都会增大) |
2HI | 增大H2的浓度,平衡逆移 | H2的转化率减小,I2的转化率增大 |
增大HI的浓度,平衡正移 | HI的转化率不变 | |
增大压强,平衡不移动 | 转化率不变 |
7.反应物的转化率高,产物的产量是否一定高
产物的产量的高低,不仅与与化学平衡时的反应物的转化率高低有关,还与化学反应速率的快慢有关。反应物的转化率高时,化学反应速率不一定快,产物的产量不一定高。只有当反应物的转化率高,同时化学反应达到平衡的速率也快时,产物的产量才高。同样,化学反应速率快时,对可逆反应,正、逆反应速率都快,反应物的转化率不一定高,产物的产量也不一定高。所以,实际生产中,应综合考虑化学反应的速率和化学反应进行的程度。
8.如何判断两反应状态能否达到等效平衡状态
可逆反应在一定条件下建立化学平衡,与反应的途径无关,平衡状态只与始态和终态相关。可逆反应在一定条件下,无论是从正反应开始,从逆反应开始,还是从正、逆反应同时开始,只要投入的反应物的物质的量满足一定的关系,就能达到相同的平衡状态,即等效平衡。判断是否是等效平衡的方法,可以采取“一边移法”进行快速判断:
A.无论反应前后气体的体积是否变化,若对反应物或生成物“一边移”后与起始投入物质的物质的量相等,在相同条件(一定温度和压强或一定温度和容积)下,反应就能达到等效平衡。平衡时,平衡混合物中各组分的浓度或百分含量等同。
B.无论反应前后气体的体积是否变化,若对某状态的反应物或生成物“一边移”后与起始投入物质的物质的量比相等,在一定温度和压强下,反应就能达到等效平衡。平衡时,平衡混合物中各组分的浓度或百分含量等同。
C.对于反应前后气体的体积不变化的可逆反应,若对某状态的反应物或生成物“一边移”后与起始投入物质的物质的量比相同,在一定温度和容积条件下,反应也能达到等效平衡。平衡时,平衡混合物中各组分的百分含量等同,但浓度不同,平衡浓度或平衡时各组分的物质的量与起始物质的量成比例。
D.对于反应前后气体的体积有变化的可逆反应,若对某状态的反应物或生成物“一边移”后与起始投入物质的物质的量比相同,在一定温度和容积条件下,反应不能达到等效平衡。

- 全部评论(0)
