电负性知识的应用
时间:2014-09-14 21:12 来源:未知 作者:王利平 点击: 次 所属专题: 电负性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.判断元素的种类
一般情况下,电负性大于1.8,为非金属元素,电负性小于1.8,为金属元素。
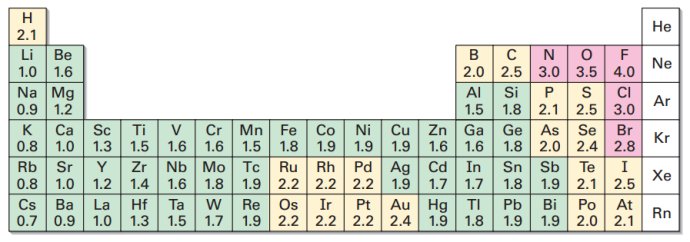
2.判断化学键类型
一般情况下,两元素电负性差值大于1.7时,形成离子键,两元素电负性差值小于1.7时,形成共价键。
例如:Na电负性0.9,Cl电负性3.0,二者之间的差值为2.1大于1.7,形成离子键。
H电负性2.1,Cl电负性3.0,二者之间的差值为0.9小于1.7,形成共价键。
3.判断元素价态的正负
化合物中电负性大的元素为负价,电负性小的元素为正价。
例如:Na电负性0.9,Cl电负性3.0,形成NaCl,钠离子为正一价,氯离子为负一价
4.判断金属性、非金属性强弱
电负性越大,其非金属性越强,电负性越小,其金属性越强。
例题:电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于电负性的变化规律正确的是(
A.周期表中同周期元素从左到右,元素的电负性逐渐增大
B.周期表中同主族元素从上到下,元素的电负性逐渐增大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
解析:非金属性越强,电负性越大。同周期自左向右,非金属性逐渐增强,电负性逐渐增强;同主族自上而下,非金属性逐渐较弱,电负性逐渐降低,所以正确的答案选A。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
