福建省2014年理综试题,题24涉及电化学腐蚀的内容。要求考生判断,海水对铁闸的腐蚀,生成铁锈最多的位置。答案是铁闸紧靠水线下的区域,,而不是在铁闸的下部。这是为什么呢?
钢铁的电化腐蚀,生锈和腐蚀是不同的两个概念,铁氧化转化为亚铁离子,变质损坏,是腐蚀;铁生成水合氧化铁是生锈。两个过程经常相伴发生。中学教材对钢铁吸氧腐蚀,是从微观上做最粗略的分析:钢铁在溶解有氧气的中性或酸性很弱的溶液中发生吸氧腐蚀时,铁失去电子氧化为亚铁离子被腐蚀;水中溶解氧从钢铁的碳上结合电子还原为氢氧根离子。和亚铁离子结合成氢氧化亚铁,并进一步转化为铁的氧化物水合物,形成铁锈。
实际上,钢铁闸门在海水中发生吸氧腐蚀的过程中,发生的原电池反应,主要是由于水中不同部位溶解氧的浓度不同而引起的。在空气与海水(或含电解质的溶液)的交界面附近,氧气的浓度比下层大, 铁闸门在空气和溶液交界面附近的区域,铁碳和溶解氧间的电极电势比较高,成为正极,发生还原反应:O2+4e-+2H2O==4OH-;而铁闸门下部区域成为负极,发生氧化反应:Fe-2e-==Fe2+。所生成的亚铁离子扩散到接近水面区域,和OH-形成Fe(OH)2,并继续演化形成铁锈。(当然,上部区域的OH-也会扩散到下部,但是,下部氧气少,形成铁锈能力弱。)相反,下部的铁闸氧化腐蚀的程度大于接近水面的区域。这在日常生活中是可以观察到的,如钉入木头很久的锈铁丁,钉的下部比上部腐蚀更严重,变的更细,钉上部表面锈的厉害。
由于我国中学教材没有介绍农差电池,学生对该问题的理解判断会有困难。有人认为,这道试题,有助于纠正教学中把铁的腐蚀和生锈混为一谈的弊病,让师生明白腐蚀最厉害和生锈最多的部位并非一致的。
关于铁闸生锈的补充(来源于 http://blog.sina.com.cn/s/blog_54b3babc0102v5k5.html)
铁闸生锈真是个复杂的现象,中学老师也不一定清楚其中的具体机理和过程,更何况是参加高考的学生。所以考查的内容虽然是简单的,但放在一个复杂的背景下考查,难道是为了考查“思维和推理能力”?
首先,先介绍一下腐蚀中的微电池(微观腐蚀电池)和宏电池(宏观腐蚀电池)模型:


那么铁闸生锈的那道题目,应该用宏电池模型进行解释C处的“腐蚀最严重”。所以学生学习吸氧腐蚀的时候,如果老师过于强调微电池(铁不纯含碳,铁为负极,碳为正极)的话,学生就会在高考中用错解题的模型,那么答案自然就容易出错。
其次,即使是用宏电池模型来解释吸氧腐蚀且属于局部腐蚀(很拗口,因为吸氧腐蚀也可以是均匀腐蚀,局部腐蚀也不一定是吸氧腐蚀)时,也有许多注意点,例如电极的位置。我们先从平面的结构来认识一下,这种局部腐蚀。将氯化钠、酚酞和铁氰化钾混合溶液滴在铁片上。[1]
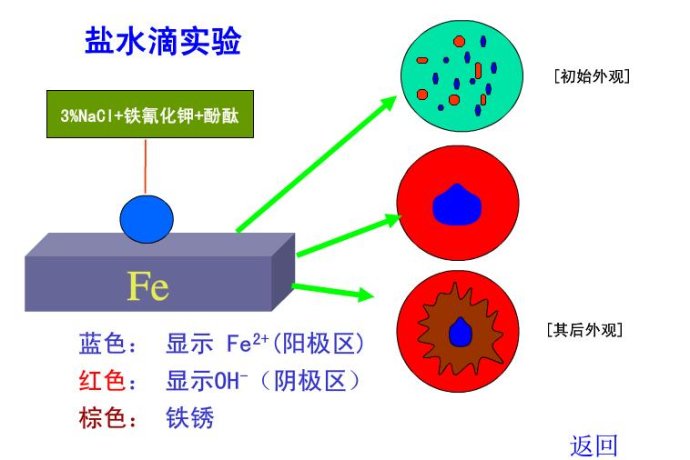
刚开始,混合溶液含氧充足且分布均匀,铁片表面的划痕存在结构性的差异——物理结构的不均匀,划痕处为负极,无划痕的地方为正极(图中的初始外观) 。
随着反应的进行,混合溶液中的氧气耗尽。水膜的边缘比较薄,有利于氧气的溶解,因此,正极的反应会逐步移到水膜的边缘,边缘出现一圈红色(中间原来红色的区域会慢慢消失,因为溶液的酸碱度发生变化)。而水滴的中心位置水膜最厚,因氧气最难溶而容易发生铁的溶解,为负极。
最后,由于离子的迁移,外围的OH-向中心传递,中心的Fe2+向外围传递,所以在水滴的中心和边缘出现一个棕色的圈[Fe(OH)3],逐渐达到稳定状态(图中其后外观) 。
所以,这样的一个静态观察的实验,正负极的位置也是存在一个变化的过程:先是微电池,随后是宏电池。更不要说海水中的铁闸,由于海水的波动,这个正负极的位置虽然能从理论上分析出来,但要在图中标出却异常困难,因此需要做一个相对静态的假想。a处为湿润的铁闸,b处为水线下不远处,C为再稍远离水线一点的铁闸。
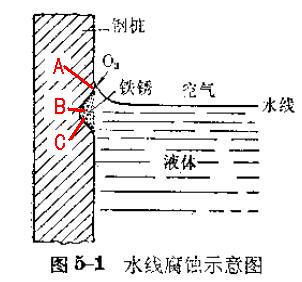
好了,模型确定了。在反应的过程中铁闸附近海水中的氧气可能会被耗尽,但是不可否认整个海水中的溶解氧是巨大(否则鱼类不能生存),远处的溶解氧最终还是会扩散到铁闸附近的(即使是稍远离水线的C处或C处以下更深的位置)。所以,生活中的经验告诉我们,毫无防护的铁件只要泡在海水中,泡到水的部分迟早都会生锈。那么,这个“都会生锈”其实就考虑到了微电池(铁不纯含碳和铁闸表面的物理结构不均等)。--这就是各版本教材中铁不纯含碳时的腐蚀微电池模型,其正负极距离很近,并非示意图中那么远。
但考试考的不是微电池,所以我们先忽略微电池的发生。首先,最容易确定正极——铁闸湿润的地方(A处)。高考题中,过于静态(没有指出a是否为被海浪打湿的地方)所以示意图不够真实。当然,A以上铁闸干燥的位置,不是正极!那么这个负极就是水线以下的全部(因为电阻不大,腐蚀电位视为相同或接近,或者按物理的理解为“等势”)——这也是生活经验中的,长期泡在水中的铁件,水线下的位置会比水线上细的缘故。注意哦,水线下的任意位置都会变细,可能不同位置变细程度会有不同,但一定比水线上来得细。在海水中,会更复杂一些,因为海水的冲刷而发生冲刷腐蚀,所以实际腐蚀程度最大的地方真不好确定,但高考题就忽视这个问题吧。
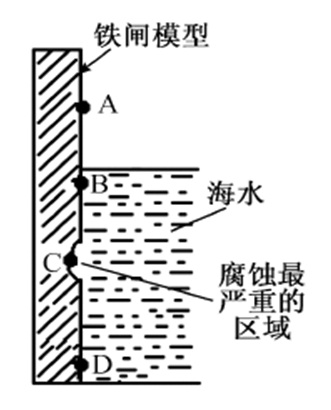
那么,可见高考题中的“C腐蚀最严重的区域”是一个假定:冲刷造成的、或由于铁闸电阻很大,“不等势”(C为腐蚀电势最低的位置)等。反正,题目已经暗示我们,C为负极。
不管题目本意是否设定“B为正极”,最终都将得出B处铁锈最多的结论。因为B离水面近,有更充足的氧气,而铁锈的生成需要氧气的作用。
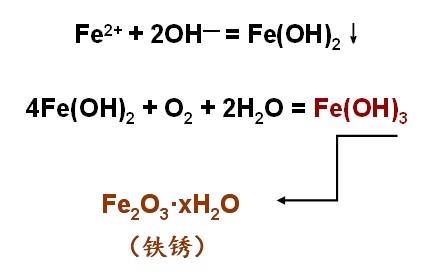
也就是说,只要有充足的氧气,B处发生微电池腐蚀,也是生成铁锈最多的地方。这里需要注意,与润湿的A处不同,A处由于是宏电池的正极,受到生成的OH-等因素影响,铁表面的氧化物比较致密,不易腐蚀而生成铁锈(当然与铁闸完全干燥的位置相比,还是会有些铁锈的)。B则是宏电池的负极(水线下都是负极),只是与氧接触更充分,因而也同时有微电池腐蚀发生,铁锈最多(微电池正负极间距近,所以铁锈就差不多在电极附近生成)。——所以B出铁锈最厚,而铁锈厚的一个好处就是会一定程度上保护内部的铁(这个保护作用很差劲,但聊胜于无)。
然后再回想C处腐蚀最严重,就可以理解了。
但高考题是这么考的吗?显然不是。其本意,应该只是预设B为正极、C为负极,B有充足的氧气而是铁锈生成最多,C为负极而溶解最多。那么这样简单的预设放在实际情况比较复杂的背景下考查,实在是不合理。因为按造宏电池的预设,C处的Fe2+要迁移到B处,与OH-生成Fe(OH)2,然后再变成Fe(OH)3,最后得到铁锈。可是海水那么大的容量,Fe2+为什么哪里都不去,偏偏跑去b处?在原电池、电解池中,离子在溶液中的传递有三种方式:扩散、对流、电迁移,在海水这样宏大而波动的环境中,这个电迁移实在不算什么,远不如海水波动造成的搅拌(对流)作用——如果搅拌一下的话,Fe2+怎么可能还会“千里迢迢”地从C点移到间隔很远的b点?所以铁锈哪里最多,要么考虑B、C间距非常近,要么就考虑“哪里氧气多,哪里就生锈多”——这是从氧气的角度来说的。但是不少学生想叉了,从铁的溶解来考虑“哪里腐蚀,哪里就生锈”,结果答成C处了——然后就答错了。
总结
所以,合理的模型应该是:A为湿润的铁闸,由于氧气最多而“钝化”作用强,是宏电池腐蚀的正极,微电池腐蚀程度很低,铁锈很少;B为水线下一些的地方,氧气充足,但由于电解质溶液多而“钝化”作用远不如A处,主要发生微电池腐蚀,同时为宏电池负极,铁锈多;C处离水线稍远,氧气不如A、B充分,因而主要是宏电池腐蚀的负极,同时伴随一些微电池腐蚀,生成铁锈虽然不如B处,但远超A处。







木棉花(1429341583) 评论 href="/plus/view.php?aid=15598">海水对铁闸的腐蚀,:D处呢,D处应该也会腐蚀啊,不是说水面以下都是负极么
