电化学中值得思考的问题集
时间:2016-03-13 18:38 来源:未知 作者:黄叶 点击: 次 所属专题: 电化学问题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原电池和电解池是高中有关电化学知识的两 个基本装置,深人了解两种装置的形成条件,判断 依据和内部微粒的运动是解决各种电化学问题的基础,但在实际的教学过程中笔者也发现了一些值得思考的问题,与各位同行交流讨论。
一、非氧化还原反应不能设计成原电池?
非氧化还原反应如Cl_+Ag+=AgCl能设计成原电池吗?可能许多中学化学教师都会肯定地说 “不行,因为构成原电池的前提条件是自发进行的 氧化还原反应。将一个反应设计成原电池时总是将 反应设计成两个半反应即氧化反应(负极)和还原 反应(正极)两部分,而上述反应不存在电子的转 移,故‘理所当然’的不能拆分成有电子得失的两部 分”。但笔者认为原电池中总化学方程式只能表示 净结果,是两个半反应的加和,不能表示具体的过 程。有可能两个半反应在加和的过程中方程式两边 删去了等量且相同的物质。如Cl-+Ag+=AgCl,可以 在原方程式基础上两边添加物质银,方程式就成为 Cl-+Ag++Ag=AgCl+Ag,此方程的两个半反应可设 计为:负极 Ag - e- +Cl-=AgCl,正极 Ag++ e-= Ag
二、原电池中离子都需移动?
原电池对外供电时,为了构成回路的需要必然要求电解质溶液(或者固体电解质)离子发生移动。 那是不是如电解池阳离子向阴极移动,阴离子向阳 极移动呢?笔者认为电解池中离子的定向移动受制 于外加电源,是一种被动行为,是非自发的,而在原电池中由于没有“外力”,离子的移动是一种主动行为,是自发的。以常见铜锌原电池为例,Zn失去电 子形成Zn2+进人溶液,使负极区Zn2+浓度逐渐变 大,同时,由于正极区溶液中的H+在正极上获得电 子形成H2,造成正极区浓度变小,最终使溶液中 的电荷分布出现不均衡,负极区正电荷过剩,正极 区负电荷过剩,为了消除溶液中电荷分布不均衡 性,可以由SO42-从正极迁移到负极,也可以由Zn2+、H+从负极迁移到正极,但前者会带来的过渡集 中,不利于体系熵值增大,不是一种自发的表现形 式,只有Zn2+、H+的迁移不但可以消除电荷分布不 均的问题,而且可使离子在溶液中尽可能地分散, 使体系熵值增大。所以笔者认为判断原电池中离子 是否移动,首先要判断电池放电过程中是否存在离 子浓度的不平衡性,若有,表现为有高浓度迁移到底浓度,对于离子浓度不变的,是否移动受到多种 因素影响,不一定移动。
三、两个相同的电极不能构成原电池?
常见的原电池有两种,一种化学电池,即原电 池两极反应的结果为一化学反应,如铜锌原电池最 后的结果为Zn+2H+=Zn2++H2。另一种为浓差电池, 是由于两电极间电解质浓度不同,或电极上反应物 的浓度不同而构成的。中学阶段的原电池基本上属 于化学电池。故在中学阶段认为构成原电池的条件 之一为两个活泼性不同的电极是正确的。但并不是 相同的两个电极不能形成原电池。如常见的氢氧燃 料电池两极经常都用镀有铀黑的铀片,实际上Pt 电极仅仅起到导电沟通回路和吸附气体的作用.本 身不参与电极反应。浓差电池中两极可以参加反 应,如金属钾溶解在金属汞中形成汞齐,可以作为电 极,当连接两个不同浓度钾汞齐电极插人KC1溶液 中,电子会由一极流到另一极。其中浓度较大的一 极上的钾易失电子,并产生K+进入溶液,同时溶液 中的K×在浓度较小的一极上得到电子析出钾,这样钾就由一极转移到另一极上,直到两极上的钾原 子的浓度相等为止。
四、电解时锌不能从水溶液中析出?
钢铁制品容易生锈,往往在钢铁件电镀上一层 锌,工业上电镀锌虽然有多种不同类型的工艺流 程,但都是在水溶液中进行。水溶液中均存在H+, 在阳离子的放电顺序中H+在Zn2+之前,也就是在 溶液中Zn是没有机会获得电子而在镀件上析出。 那为什么会有镀锌工艺呢?电解时聚集在阴阳两极 的阳离子和阴离子得失电子是有先后的,这种次序 不仅跟离子本身有关,而且与离子浓度的大小也有关系。定量的可以用电极电势φ来计算,φ值越大,说明高价离子越容易得到电子变成对应的低价离 子。当 H+ 和 Zn2+浓度均为 1 mol/L 时,φ(H+/H2)=0, φ(Zn2+/Zn)=-0.76,显然 H+ 和Zn2+浓度相同时 H+ 优先得电子。镀锌工艺中常用含锌化合物作电解 液,溶液中Zn2+浓度远远大于H.浓度,可以实现 Zn2+优先放电。所以笔者在实际教育中对于阳离子在阴极放电顺序处理如下:Ag+>Fe3+>Cu2+>H+> Fe2+>Zn2+>H+>Al3+>Mg2+>Na+,其中前一个 H+ 是有酸电离提供的H+,浓度较大。后一个H+是非酸环 境中,溶液中的H+来自水的电离,浓度较小。
五、原电池?电解池?
电解池中与直流电源正极相连的为阳极,与负极相连的为阴极.原电池本身就是直流电源,所以可以用原电池实现电解池供电。
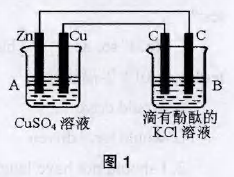
如图1所示,A池 中锌与硫酸铜的反应是自发的,为原电池;B池中两石墨电极与KCl溶液无自发反应为电解池。假如 两个装置单独时均为原电池,那连接以后是不是还 都是原电池呢?
如下图2所示,
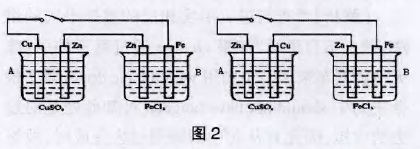
左右两个 装置能自发的进行Zn+Cu2+=Zn2++Cu 和 Zn+2Fe3+=Zn2++2Fe2+,由于Fe3+的氧化性 强于Cu2+ ,A为电解池,B为原电池。开关闭合时,A 中铜电极为阳极,Cu-2e-=Cu2+,锌电极为阴极。 Cu2++2e-=Cu,总过程类似铜的电解精炼。若将A装置中的铜锌两个电极互换,如上右图所示,则A中锌电极反应式Zn-2e-_=Zn2+,铜电极反应式 Cu2++2e-=Cu,总反应为 Zn+Cu2+=Zn2++Cu,此反 应也是自发的,从能量角度分析A装置的体系能量 也是减少的,所以A装置也是原电池,此图可以看成两节干电池后用导线首尾相连,形成短路, 外接电源加速了Zn+Cu2+=Zn2++Cu反应进程。

- 全部评论(0)
