活化分子有效碰撞问题的探析
时间:2016-03-24 17:41 来源:未知 作者:黄叶 点击: 次 所属专题: 有效碰撞
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一个化学反应一般经历的过程可用图1表
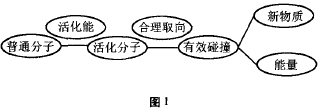
上述流程揭示:在反应物分子(普通分子)获 得了一定能量后变成活化分子的基础上,必须在 合适的方向上进行碰撞才能构成有效碰撞,从而形成化学反应,生成新物质同时伴随能量的发生, 可见活化分子的碰撞是有效碰撞的必要条件,形 成活化分子的有效碰撞包含了空间与能量两个方面。
这里以NO2 + CO ==NO + CO2的化学反应为例,从两个方面进行探究说明形成有效碰撞的重要条件。
一、初识活化分子与活化能,构建模型基本框架
具有较高能量,能够发生有效碰撞的分子称为活化分子。实验证明,分子之间碰撞的能量大于等于临界能量E0时,才可能发生有效碰撞。从
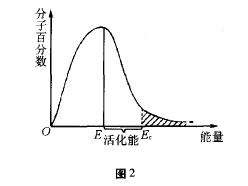
等温下分子能量分布曲线(如图2所示)来看,反 应物分子的能量可以从0→∞,但是具有很低能 量和很高能量的分子都比较少,具有平均能量的分子相当多。E表示分子的平均能量,Ec是活化分子具有的最低能量,E与Ec之差叫活化能,不同的反应具有不同的活化能。反应的活化能越低,则在指定温度下活化分子数越多,反应就越 快。从不同温度下分子能量分布曲线(如图3所 示)上看,当温度升高时,气体分子的运动速度增 大,不仅使气体分子在单位时间内碰撞的次数增加,更重要的是由于气体分子能量增加,使活化分子百分数增大;温度为t1时活化分子的多少可由面积A1反映出来;温度为t2时,活化分子的多少由面积A1+A2反映出来。从图中可以看到,升高温度,可以使活化分子百分数增大,从而使反应 速率增大。
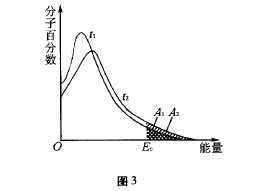
二、巧妙引入实例分析,从空间与能量角度解 释活化分子的碰撞不一定是有效碰撞
1.空间因素
反应物NO2与CO分子周围存在着电子云, 当他们相互靠近时分子的键长和形状发生了明显 的变化,当NO2与CO分子在特定的方向上相互 碰撞时,发生化学反应,过程如图4所示。
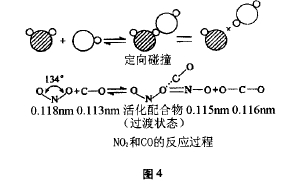
可见,上述NO2与CO的反应过程中,当 N-O和C-O在一条直线上相互接触时,最有利 于“活化配合物”的形成,有利于形成有效碰撞, 有利于化学反应的进行。
2. 能量因素
活化能,即活化分子高出反应物分子平均能 量部分。反应物分子必须具备一定的能量(即大 于或等于临界能)才能成为活化分子,才有可能 发生有效的碰撞。
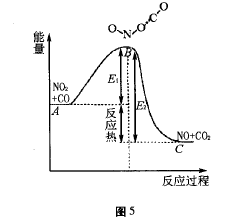
NO2与CO分子周围存在电子云,当它们靠 近时由于电荷之间存在库仑斥力的作用,只有具备足够能量的分子,才能克服这种库仑斥力进行有效的碰撞,即形成过渡状态下的“活化配合 物”。此时原有的N-O键部分断裂,新的O-O 键部分地形成。这种活化配合物既可以分解而成 反应物NO2和CO,又可以形成生成物NO和 CO2。如图5所示,反映了上述反应过程中能量 的变化情况。图中A点为NO2+CO系统的平均 能量。在此状态下,NO2与CO不能发生有效碰 撞,即不能发生化学反应;若NO2 +CO系统的能 量等于或大于B处的能量时,两者才能发生有效 碰撞形成中间状态“活化配合物”ONO-CO,进而 反应形成反应物NO + CO2;图中C点表示NO + CO2系统的平均能量。从图中可以看到,E1是正反应的活化能,E2是逆反应的活化能。E2和 E1之差是化学反应的热效应。正反应是放热反应, 逆反应是吸热反应。
总而言之,普通分子获得活化能量后变成活 化分子,这些作为反应物的活化分子只有在空间 和能量两种因素都满足的情况下,才能发生有效的碰撞,进行化学反应。当然对于活化分子的有 效碰撞问题,还可以利用简化模型进行解释和理 解,这不仅是科学认识的重要方法之一,同时也是 高中化学教师在平时的教学过程中经常进行有效 训练的重要手段。

- 全部评论(0)
(2257974338) 评论 href="/plus/view.php?aid=15821">活化分子有效碰撞问:可以可以,谢谢啦,
