《化学反应方向--增熵和减能》实录
时间:2016-05-16 22:38 来源:未知 作者:邵磊 点击: 次 所属专题: 熵判据 反应方向
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
陈勇老师根据录像记录整理
一、自发变化的基本趋势
这个教室里充满了空气,看不见摸不着,但是它客观存在。研究表明,这些气体的分子无时无刻不在做杂乱无章的、高速的运动。而且据说是折线形,为什么,到处是分子,要碰撞。常温常压下,这些气体分子的平均速度可以达到甚至超过500米/秒,如果允许它走直线,就是超音速了,知道音速是多少吗,340米/秒。
既然是杂乱无章,既然是高速,那么,某一个分子,譬如一个氧分子或氮分子,它下一秒在什么地方出现都是可能的,一切皆有可能,那么有没有这样的可能,说在某个时刻,在我们这个房间的后半间充满了氮气,一个氧分子没有,在我们这间房间前半间充满了氧气,一个氮分子没有,我在这里说话,说着说着忽然来劲了,定睛一看后排同学……全倒下了,有没有这种可能?生活经验告诉我们,这种事情从来没发生过,用数学的语言来表达,出现这种事件的概率是某一个天文数字的倒数,几乎为零,吹毛求疵的话我还不能说它就等于零。那么同学们想一想什么事件的概率是最大的呢?那就是我在空间随便抓一把,前面抓一把,后面抓一把,这两把空气的成分基本上是一致的,都是氮氧分子充分混合的,我们前后呼吸没有觉得两样。这两把空气当中氮气的成分大概是五分之四弱,氧气成分大概是五分之一强,这是我们遇到的最大概率的事情。
热力学,它是我们物理学的一个重要分支,也是我们化学的一门重要基础课。热力学定义了一个物理函数,或者叫物理量,这个物理量叫熵,火字偏旁,一个数学上除法的那个商,英文符号是S。既然是一个物理量,它一定有大小多少。譬如说长度是一个物理量,那么有长有短;温度是一个物理量,那么有高有低;压强是一个物理量,那么有大有小;熵是一个物理量,它就有大小、多少、高低之分。如果真有这么两件房间的话,一间充满了氧气,另一间充满了氮气,分门别类,氧归氧,氮归氮,我们认为这样的一种排布是有序的,有秩序的;而氮气和氧气充分混合,全搅在一起的,到东到西都一样的,都是五分之四、五分之一的关系,这种情况我们认为是相对无序的。热力学把这种相对有序的、分门别类的情况看作熵值比较低,低熵;把这种氮气氧气充分混合的状况,比较混乱的,比较混合的,叫做高熵的状态,这就是熵这个物理量高低大小之分。于是这个熵就有了一个比较通俗易懂的别称,叫做混乱度。什么是熵,就是混乱的程度,混乱度。当然,混乱这两个字在这里没有贬义,说哪个地方出事了,说这个社会混乱了,不是这个意思,其实这混乱两个字包含了自由,譬如氧分子原来呆在这个小空间,这会儿可以到更大的空间去运动,自由度就高了。活跃,氮分子也好,氧分子也好,空间大了以后,就更加活跃,更加混合。所以混乱两个字其实包含了自由、混合、活跃、无序等等的意思在里头。这个不混乱的状态叫高熵,这个混合的状态叫低熵。
生活经验告诉我们,一旦把这堵墙打开,别说打开,就打个洞吧,这个氮气氧气的分子就会互相穿来穿去,就会自动地,我们叫自发地,变成这种状态(混合的),而反过来,你要把这种氮气氧气混合的状态变成氮气氧气分离的情况,需要人力、物力、财力。记得怎么做吗,给它高压,给它降温,降到多少度?将近负的两百度,就是把空气液化,然后利用沸点的区别,把它在低温下蒸馏出来,蒸完之后压入特制的钢瓶,这钢瓶还不能漏气,一漏气又出来了,追求自由去了。
假定这是一小撮盐,这是一大杯水。盐归盐,水归水,相对是比较有序的,我们把这种状况叫做低熵的状况,低混乱度的状况。一旦把这撮盐投入到水中去,它立马会自发地变成什么状况?溶液的状况,也就是说,它的钠离子,水分子,氯离子都是互相混合在一起的。生活经验告诉我们,一碗汤,你喝下去每一口都是一样咸的,不可能第一口是腌笃鲜,第二口就是农夫山泉有点甜,不可能,最大的概率是充分混合的。溶液的状况,氯离子、钠离子、水分子,充分混合的状况,当然是自由度更高的,混乱度更高的,混合度更高的,这个状态我们把它称作高熵的状态。反过来又得费牛劲了,如果一桶海水提上来,吹口气就变淡水的话,那人还缺什么水啊,我们不是缺水吗,缺什么水?淡水,人类就那么尴尬,守着大海就是缺水,缺淡水。还好有老天爷帮忙,源源不断地把海水蒸到天上去,要不然哪来的黄河,哪来的长江,哪来的生命?前面大家都学过了,所以这个状态(盐和水)到这个状态(盐水溶液)也是自发的过程。
这是一块干冰,见过干冰吗?克莉丝汀夏天卖冰激凌会放干冰。干冰,它是一种固体,一种晶体,干冰的内部二氧化碳分子是相对不自由的,它是有固定位置的,就好比下课的时候,我们这些同学处于气态的状况,到东到西,东南西北,互相的方向、位置是可以交换的,一旦上课铃响,进了这个教室,坐下来之后就是固态状况,同学之间一般是不交换位置的,运动就大大降低了。当然分子之间会有震动,转动,譬如说摇摇头啊,眨眨眼啊,这还是有的。你悟出来没有,什么叫熵值为零啊?一切热运动均告中止。什么状态,什么温度?绝对零度,相当于摄氏零下273.15度的时候,这个时候摇头、眨眼睛都没有了,这样一块纯净的晶体,我们把它的熵值定义为零,彻底不混乱了。你从克莉斯汀蛋糕店把这块干冰拿回家去,你当然很好奇,想仔细观察,甚至想做点实验,可惜好景不长,很快就挥发了,升华了,气化了。同学们还有印象吗,气化,在常温常压下这点气体大概是固态时候体积的多少倍?有印象吗?千倍左右,怎么来的?学气体摩尔体积的时候,说气体分子之间的距离大概是它固态时候10倍左右,气体体积主要是由分子间的距离决定的,而不是分子本身大小决定的。气体分子之间的距离大概是它固态时候10倍左右,立方一下,不就是千倍吗?所以,常温常压下气态的体积是这点物质固态时候的体积的千倍左右。到了这么大的一个空间,杂乱无章的运动,折线形的运动,每秒500米的运动,当然这种混乱度,自由度,融合度要高得多,所以气态是高熵的状态,干冰处在低熵的状态。我们知道气化这个过程是自发的,反过来要把二氧化碳气体收集起来变成干冰,又要花钱了,人力、物力、财力,它不会自动的。
[板书]热力学
低墒
N2/O2
氯化钠/水→
干冰
我们国家长期以来是一个农业社会,我们曾经城乡差别非常明显,工是工,农是农,城是城,乡是乡。这个当然首先是历史造成的,世界上任何一个发达国家曾经都是农业社会,大家都是从原始社会走过来的,曾经都是靠天吃饭的。当然,后来有一些人为的因素,譬如说不民主啊,不发展生产啊,造成我们长期以来是一直是农业大国。说起来在座的同学可能有点不大相信,二十年以前,三十年以前,上海市区的那些名牌高中的优秀毕业生北大、清华是不去的,为什么?迁户口啊。户口一迁就不是上海人了,回不来了,就拼命保住自己的户口。而乡下的农民呢,他可能一生一世只能在自己的这块土地上生老病死了。其实这种城是城、乡是乡、工是工、农是农、上海是上海,安徽是安徽这样一种分门别类的、不活跃的状态,或者说不混乱的状态,或者说相对有序的状态,或者说我们今天在朝鲜还能看到的这种状态,听说它外地走个亲戚还要申报的,这样的一种社会状态实际上是一种低熵的状态。但是历史潮流不可抗拒,今天我们有幸亲眼看到这种城乡的差别、工农的差别在我们这里正在缩小,大量农民进城,大量原来的农村城镇化了,像我们川沙二十年以前那就是典型的农业县,现在也城镇化了,浦西的好多人也搬过来住了,所以社会形态的发展也是自发地从低熵到高熵。
说了那么多故事,总结一下,说了什么?物质世界的自发变化的基本趋势,它是从低熵到高熵来发展的,这是它的自发变化的一大基本趋势。
除此以外,还有一句话大家都是知道的,水总是往低处流的。你要让水往高处流,假定你家住八楼、十楼的话,你把自来水一打开,水就是往低处流。你想过没有,当初这自来水怎么到你家里去的,肯定是水泵打上去的啰,抽水机抽上去的啰,哪有它自发爬到上面去的。水往低处流,据说当初大禹治水伟大就伟大在这个地方,他懂得水堵是堵不住的,只有疏。水自然往低处流,我们对水往低处流有各种解释,譬如说地球引力,重力。如果我们把这个观点,适用范围扩大一点的话,我们的解释是这样的,水在高处的时候,势能是高的,水在低处的时候,势能是低的,也就是降低了自身的能量。不要小看这个势能,这个势能是可以用来做功的,可以用来发电的,甚至可以将千百个村庄夷为平地的,所以水往低处流这句话实际上表达的,从更广泛的意义上来讲,实际上表达的是降低自身的能量。这样的话,物质世界自发变化的基本趋势就有两个制约因素,不是一个,第一个熵增加,第二个自身的能量下降,这是一个基本规律。这可能是你们课本里没有的,但是大家理解,今天老师为什么给你讲这东西。
自发进行既然有两个要素,下一个什么问题,必然会遇到一个问题,两者是否一致?你这里有点事,回去跟父母申请,你爸妈意见一致,没什么好讲,如果你父母意见不一致,一个意见是对着事情有利的,一个意见是对着事情不利的,那就看谁嗓门大,如果你家里妈妈一言九鼎的话,爸爸的意见仅供参考。
这个自发变化包括化学变化、物理变化、包括社会形态变化。举个例子,锌片投入到盐酸中去,自发产生氢气变成氯化锌。我们在这个化学变化中,很明显看到,整个体系的熵值明显上升的,它原来是固体,结果变成气体了,刚才讲气体体积是固体体积的千倍,活跃度、混乱度、自由度极大提高,这个过程肯定是熵值提高的过程。当时同学们做这个实验的时候,我不知道大家摸没摸过试管璧,这反应是什么反应,放热的,试管壁甚至是烫的。那么对这个反应来讲,那不是两者一致了吗,它既是增熵的,又是降低自身能量,减能的,把自身能量放掉的,所以这个反应肯定是自发进行的。
我们回过头来看这个,氮气、氧气本来分开,它自发地混合在一起,熵肯定是增加的,那么能量呢?这里没有涉及到化学变化,应该说能量基本上没有变化,只不过分子之间的相对位置调整了,能量基本没有变,但是它熵是增加的,两者的代数和,结果它是自发进行的。
我们看这个例子,氯化钠溶于水,混合了,熵是增加的,能量在这里变化不大,你做那个实验摸过那个试管吗?恐怕那热效应不明显。一个变化不大,一个熵值明显增加,两者的代数和,这个它是可以自发进行的。
那我换了啊,眼睛瞪大点看啊,我把氯化钠换成硫酸,你告诉我怎么回事?放热哇?我们还担心呢,这个东西是不是把液体溅出来,所以规定要怎么配的,浓硫酸往水里面倒,而不能倒过来,就是防止它溅出来,当然放热的。而且它既然分散了、融合了,氢离子、硫酸根离子、水分子充分混合了,这个熵肯定提高的。对硫酸的溶解来讲,不仅熵提高的,而且还是放热的,那么这个过程肯定是可以自发进行的。
我再换,我把这个硫酸换成硫酸钡,换成硫酸钡,你说怎么回事?大家都知道硫酸钡是不溶于水的,如果它分散开来,变成硫酸根离子、钡离子跟水分子充分混合的话,这个熵值肯定是提高的,干嘛不溶解呢?可想而知,这些硫酸根离子和钡离子原来都是离子键(结合),一个个拆开,拆碎了,在拆的过程中一定是吸热的,结果它吸热的嗓门比熵增加的嗓门大了,最后它是难溶解的。
我们看第三个例子,干冰变成气化的二氧化碳。刚才讲,熵是增加的,但你知道这个过程是吸热的放热的?当然是吸热的咯,克莉丝汀用它干嘛,就是用它来保证冰激淋到家没化掉,给它降温的,吸热的。这两者不是矛盾了吗?熵增加有利于它自发进行,吸热不利于自发进行,这两者不是矛盾的吗?结果你说谁嗓门大了?熵增加的嗓门大了,它盖过了吸热的效应,最后实践证明它是自发的。所有自发的过程,都是由这两个因素来制约的,至于两个因素如果不一致的话,这里看谁的这种效应更加明显了。这个是我要讲的第一个标题:自发变化的基本趋势。
下面回到化学上来,说是两个因素,我现在说这么一句话,化学变化的过程当中,也是由这两个因素制约的,一般来讲,对化学变化来讲,热量的这个嗓门要高于熵变化的这个嗓门,所以很多的化学反应它能不能进行,能不能自发进行,是取决于它的热量的变化。
二、化学反应的热效应
印象之一:很容易进行的反应(自发反应)多数放热
[PPT]
化合H2O+CaO→Ca(OH)2+Q
2Na+Cl2→2NaCl+Q熵减
NH3(g)+HCl(g)→NH4Cl+Q熵减
置换Zn+2HCl→ZnCl2+H2+Q熵增
复分解2HCl+CaCO3→CaCl2+H2O+CO2↑+Q熵增
NaOH+HCl→NaCl+H2O+Q熵减
NaBr+AgNO3→AgBr↓+NaNO3+Q熵减
极少数反例NH4HCO3+HCl→NH4Cl+CO2↑+H2O—Q熵增
看一些具体的例子,我们首先有个印象,很容易进行的反应,也就是我们讲的自发的反应,多数是放热的,就是我刚才讲的,两个因素制约,热量这个因素是为主的。我们看实例,大家非常熟悉的反应,首先看化合反应,水和二氧化碳化合,这是非常简单的一个化合反应,这个反应它是放热的,如果这个反应量很大的话,甚至水可以像沸腾一样,放热的,这个反应是可以自发进行的。因为这个反应它没有涉及到气体,所以我现在不给它下定论,这个熵是增加的还是减少的,怕大家不理解。
2Na+Cl2→2NaCl+Q熵减
这个也是化合反应,这个化合反应是属于氧化还原反应,这个反应我们不查数据,也可以明显看到它应该是熵减的,同意吗?因为它原来是气体呀,现在变固体了,熵肯定是在减的,但是它是放热的,所以,大家做过这个化学实验或者观察过这个化学实验都清楚,这个化学反应可以自动地、自发进行的,那就是我刚才讲的,热量的因素是占主导。
NH3(g)+HCl(g)→NH4Cl+Q熵减
这也是一个化合反应,是不是能够更明确地说它是熵减的,能说吗?左边的氨是气态的,氯化氢是气态的,氯化铵是固体啊,它是盐啊,但是它是可以非常自发地进行的,很容易进行的,因为它是放热的。这些都是大家很熟悉的反应。
下面我们看置换反应,这个例子(Zn+HCl)刚才举过了,两者是一致的,既是放热的,又是熵增加的。
Zn+CuSO4→ZnCl2+Cu+Q
这个也是个置换反应,我没有标出来,它是熵增加还是熵减少的,因为这个反应没有涉及到气体,但是它肯定是放热的,这个反应肯定是自发进行的,你把锌片投入铜盐当中,紫红色的铜马上出来了。
复分解2HCl+CaCO3→CaCl2+H2O+CO2↑+Q熵增
再看复分解反应,这也是大家很熟悉的一个反应,石灰石跟盐酸来反应,放出二氧化碳,这也是两个有利,既是放热的,又是熵增加的,两方面是一致的,没问题吧!
NaOH+HCl→NaCl+H2O+Q熵减
这是个酸碱中和反应,这个地方我肯定地说它是熵减少的,因为它原来是氢氧化钠和盐酸啊,这个溶液原来是四种离子,钠离子、氢氧根离子、氢离子、氯离子,本来四种离子,后来一反应变成两种离子了,钠离子、氯离子,这水不是离子了,绝大部分的水是不电离的,所以它的混乱度、活跃度肯定是极大地下降的,这个熵减少,熵减少应该是不利于它自发进行的,但是做过这个实验的都知道它一定是自发进行的,因为它放热的,而且这个反应是非常迅速的,如果当时有指示剂在的话,这个指示剂立马变色的,当时有温度计在的话,这个温度计的刻度是立马上升的。
NaBr+AgNO3→AgBr↓+NaNO3+Q熵减
这也是复分解反应,也是熵减少的,因为沉淀掉了嘛,溴化银沉淀了,原来它有四种离子,现在只有钠离子和硝酸根两种离子,但它是放热的。
极少数反例NH4HCO3+HCl→NH4Cl+CO2↑+H2O—Q熵增
所有我这里列举出来的离子,不管是熵增还是熵减的,最后都是看放热的脸色行事的,这些反应都是可以自发进行的。所以我们说印象之一,很容易进行的反应、自发反应多数是放热的。既然这么说,言下之意还是有反例咯,但是反例很少,极少数的反例,像这种碳酸氢盐,碳酸氢根和氢离子的反应,它是吸热的,好在它是熵增加的,因为它产成气体的,所以这个反应还是能够自发进行的。我这里用了极少反例这个词,很少。这个是我们关于化学反应热效应的印象之一,这里罗列的反应式是大家非常熟悉的,有的甚至从初中就开始学了。
[PPT]
少数化合反应吸热
C+CO2 2CO-Q熵增
2CO-Q熵增
I2(s)+H2(g) 2HI(g)-26.5KJ熵增
2HI(g)-26.5KJ熵增
N2+O2 2NO-Q
2NO-Q
N2+3H2 2NH3+Q熵减
2NH3+Q熵减
刚才我们特别提到了化合反应,化合反应多半都是放热的,但有几个我们比较熟悉的例子,第一个是碳和二氧化碳化合成一氧化碳,这个反应是吸热的,像这样的例子不多,化合反应还吸热。第二个固态的碘和氢气化合成碘化氢,它是稍微吸一点热的,同学们注意26.5这个数字不算大的,大的要达到100多,但它熵倒是增加的,看出来了吗,为什么熵是增加?因为左边的气体只有1mol,右边2mol,对第二个反应来说,这两个因素是相左的,这两个因素相互扯皮以后,它这个反应就不爽快了,正的不爽快,逆的不爽快,成了可逆的。第三个反应是我们大气固氮的基础,放电,干嘛要放电,干嘛要雷公来帮忙啊,因为它是要吸热的,就是要给它提供能量的。为什么它吸热蛮厉害的,记得吗,化学反应首先要把旧键打开,氮氮之间什么键?叁键,三股绳子拴在一起,你要把它打开,要给它消耗很多的能量,就难了,这个化合反应它是吸热。再底下这个化合反应就是合成氨了,合成氨你看熵是减少的,左边是几摩尔气体?右边?气体的体积,气体分子数明显在减少,这个反应是减熵的,但是它放热,所以这个反应勉强可以进行,它是可逆的,因为熵减少是不利于它自发进行的。
印象之二:分解反应多数吸热
[PPT]
2KClO3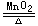 2KCl+3O2↑-Q
2KCl+3O2↑-Q
2KMnO4![]() K2MnO4+MnO2+O2↑-Q
K2MnO4+MnO2+O2↑-Q
煅烧石灰石CaCO3 CaO+CO2↑-Q
CaO+CO2↑-Q
干粉分解NaHCO3![]() Na2CO3+CO2↑+H2O-Q
Na2CO3+CO2↑+H2O-Q
(以上几例均为熵增)
极少数分解反应放热,如2H2O2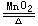 2H2O+O2↑+Q同时增熵
2H2O+O2↑+Q同时增熵
回过头来,刚才讲了化合、置换、复分解,唯独没讲到分解反应。我们说大部分的化合反应都是放热的,少数的化合反应它是吸热的,那么下面我们专门来讲讲分解反应,分解反应它多数是吸热的。这个初中就知道了,实验室制氧气,当然是一个分解反应,它是吸热的,你必须持续地给它加热,否则的话那边排水集气法集不到氧气了。实验室制氧气还有一个什么办法?高锰酸钾,也是分解反应吧,这个反应也必须要持续加热,为什么,它要吸热啊。再看,煅烧石灰石,煅烧什么意思啊,干嘛要给它煅烧啊,煅烧就是给它提供能量,因为它要吸热,它是分解反应。再看这个熟悉吗?碳酸氢钠分解,干粉分解,我们甚至可以利用这个反应灭火的,为什么?它是吸热的,它是个分解反应,吸热本身就有利灭火,降温嘛,况且它产生二氧化碳和水。所以分解反应多数是吸热的,而恰好刚才的几例熵都是增加的,熵增加有利于它反应,但不作数,热的嗓门比它大,你非得给它加热,还是回到我刚才那句话,对化学变化来讲能量的变化比熵的变化要来得更加重要。我考你一下,你给我举个反例,分解反应是放热的,我说大部分的分解反应是吸热的,既然讲到大多数,那就肯定有反例,你举个反例,有没有,分解,但是放热,这例子实在太少……对了,还是有同学想出来了,双氧水分解。放热,它还熵增加,本来双氧水液态的,变成氧气放出来,所以这个反应倒是自发进行。这个说明什么呢,特殊在什么地方,为什么属于少数的呢?我们解释是双氧水本身太不稳定。
印象之三:燃烧都是放热的
[PPT]
镁带、氢气、乙炔、硫磺,铁丝、白磷、木炭的燃烧;钠、铁、氢在氯气中燃烧;镁带在CO2中燃烧
葡萄糖在体内氧化放热从而维持体能C6H12O6+6O2→6CO2+6H2O+Q
汽油燃烧放热C8H16+12O2→8CO2+8H2O+Q
白磷在空气中放久了会自燃,缓慢氧化会放热。
大部分燃烧需要“引燃”,那只是开始阶段对反应的“引发”,并非全过程需要能量,比如碳的燃烧。
刚才讲第一个印象是自发进行的反应大部分是放热的;第二个印象,化合反应大部分放热的,分解反应大部分是吸热的;第三个印象,燃烧都是放热的,我这里写了镁带、氢气,都是大家熟悉的,乙炔、硫磺,铁丝,还记得吗,铁丝在氧气中燃烧,集气瓶底下还铺了层砂子,防止烫了破裂。白磷,初中肯定做过,木炭的燃烧,烧烤烧烤就是烧木炭。还有钠啊铁啊氢啊在氯气中燃烧,镁带在二氧化碳当中燃烧,发光发热,燃烧应该都是放热。还包括一些缓慢的氧化,我们吃饭,吃葡萄糖,这个葡萄糖在体内缓慢地氧化,这不叫燃烧了,否则我们人烧起来了,不是这么回事,但是它为我们人类提供能量的。汽油燃烧,没有明火的,你看汽车开过来,不是一路上烧过来,它应该属于缓慢氧化,但它是放热的。还有白磷在空气中放久了会自燃,缓慢氧化它是放热的,放热到着火点,还记得着火点吗,40摄氏度它就烧起来了。像铁器的生锈,包括家里放着的食物,米饭变坏了,变质了,变馊了,都会有放热的,馊饭是摸上去可能比较热的那种。还有这里要注意一下,那个引燃,那和自发不自发是两码事,像同学们手里有一张纸,纸不会自己烧,你要引燃一下,你不能说纸需要引燃所以纸的燃烧不是自发的,纸的燃烧当然是自发的,但是要引燃一下,引发一下,换句话说给它活化一下,再换句话说给它预热一下、热身一下,一旦它动起来,接下去就是自发的。这是我们的第三个印象。
[PPT]
工业生产硫酸的三步主要反应都是放热的(同时是熵减的)
4FeS2+11O2→2Fe2O3+8SO2
2SO2+O2→2SO3
SO3+H2O→H2SO4
回顾一下工业制硫酸的三个过程,第一个,煅烧,你说这个放热吗?当然放热,否则怎么叫烧啊,当然是放热的。第二个什么反应?化合反应,刚才讲了大部分化合反应是放热的。第三个反应,也是化合,所以我们肯定地说,不用老师提示,这三个反应都在我们说的大多数之列,它们都是放热反应。同时我们看到这三个反应都是熵减的,告诉我原因,第一个,左边11mol 氧气,后来变8mol,我们肯定地说过程中是熵减的;第二个反应3mol 气体变2mol 了……
印象之四:热效应是化学能的主要表现形式
[PPT]
热量是能量的重要形式,但不是唯一形式。其它能量形式还有电能、光能、机械能等。
比如镁带燃烧就释放热能和光能,光能也用于引发H2和Cl2爆炸式化合,或AgBr的分解等。
2AgBr→2Ag+Br2
汽油在汽车发动机内燃烧,能量最后是将化学能变成机械能
电能可供给化学反应需要的能量,比如电解水或电解饱和食盐水
2H2O2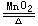 H2↑+O2↑-Q熵增
H2↑+O2↑-Q熵增
2NaCl+H2O![]() H2↑+Cl2↑+2NaOH-Q熵增
H2↑+Cl2↑+2NaOH-Q熵增
以上反应我们今天都可以用熵增和熵减,或者能量的吸收和释放来做一个解释,这就是今天我要讲的第二个内容,是化学的内容,其实大家都很熟悉,化学反应的热效应。
三、辩证逻辑与形式逻辑
[PPT]
为什么要学平面几何
讲一个可能大家听起来有点深奥的东西。哲学当中讲逻辑,逻辑的基本方法我们分两大类,一类叫做辩证逻辑,一类叫做形式逻辑。
什么叫辩证逻辑,它的基本特征是什么,那就是讲究对立统一,讲究一分为二。说坏事里面有好事,好事里面有坏事,我今天遇到坏事了,他说塞翁失马,焉知非福?我今天遇到一件好事了,还没来得及高兴呢,他说水满则溢,月满则亏。什么都是相对的,对立统一,一分为二的。他说尺有所短,寸有所长,他说公说公有理,婆说婆有理等等,这些就是辩证逻辑的基本特征。
什么叫形式逻辑,形式逻辑的基本特征就是每一步、每一点、每一滴都必须摆事实、讲道理,都要严格地、严密地加以证明,不带半点的含糊。知道形式逻辑的典型代表是谁吗?就是你们已经学或正在学的平面几何,它就是形式逻辑的最典型代表。我说角A等于角C,你用量角器尺量100遍,说这两个角都是50度,不作数,因为你不能保证小数点后面一位、两位、三位、四位、五位……都是相等的,你必须严格地证明它。譬如说,你要先建立一个平行线的概念,什么叫平行线,然后在两条平行线之间画截线,然后证明内错角是相等的,对顶角是相等的,然后你要证明角A等于角B,角B等于角C,好不容易,一步一步下来最后得到结论,证明角A等于角C,这才算数。这就是形式逻辑的基本特征。它拒绝公说公有理,婆说婆有理的,尺就是尺,寸就是寸。按说,这两种基本逻辑思想、基本逻辑方法没有高低优劣之分,都很重要,都很有用,问题在于两者不可偏颇。有句话说,清官难断家务事,社会上所有的事情你都要用形式逻辑的方式去解决它,那叫书呆子,什么东西都要严格证明,一点亏都不能吃的,丁是丁,卯是卯,那不可能。但是反过来,你不能只有辩证逻辑,没有形式逻辑。既然公说公有理,婆说婆有理,如果缺少形式逻辑的制约,任凭公说公有理,婆说婆有理发展下去,最终肯定导致一种恶果,什么恶果,谁的权势大谁最有理,结果当官的最有理,既然什么都可以辩证嘛,
这个话题很大,我不想展开。我今天特别想问同学的一个问题是,你在学平面几何的时候,你有没有想过学习平面几何的伟大意义。你有没有想过它真正的价值在什么地方。我知道你们是最优秀的高中生,我假设,如果你认为你学平面几何是为了那一大堆永远做不完的题目,是为了一次又一次的考试,包括中考,将来还有高考,平面几何后续还有立体几何、解析几何等等,如果你是这么认为的话,我作一个预言,我认为你学不好,因为你不知道它的意义。甚至会有成年人告诉你:什么对顶角、内错角,我这一辈子就没用过,除非那个人正好是一个工程师,他是专门设计图纸的,他可能要用,一般人用不上。
那我干嘛要去学它呢?你必须要理解这个平面几何最伟大的价值就在于训练了我们这种形式逻辑的意识与习惯。你有了这样的一种认识,你会热爱它,你会对它感兴趣,你会心甘情愿地训练这东西。
我在这里举了一个比较大的例子,平面几何,为什么要学平面几何。我听你们校长讲,在座的同学有相当一部分同学过两年之后,高三毕业以后,是要奔那个复旦、交大去的,我这里给你做个预言,到时候能够考上这些名校的,甚至北大、清华、港大的,一定是什么学生?是那些把书一天一天读薄的学生,譬如说我举个例子,化学,五本书、六本书,然后再加必要的习题集、辅导材料,就算十本书,我就算它1500页,如果你读到高三,临近高考的时候,你发现,我把1500页的书读成了3000页,那就完蛋了,为什么会读出3000页来呢,因为永远做不完的题目呀,你不理解这东西,然后就死命做题,然后100道题目做完之后,101道题还是无从入手,对你来说还是新的。那你应该后悔,当初国家号召,初三毕业的时候尽可能多的同学应该去上职校,你干嘛不响应号召,到这里来浪费时间。
如果你发现你的一门化学从1500页读到后来只剩了30页了,你去考复旦,考交大去了。因为你理解了它的价值,你最后发现它核心的东西并不太多,你会认为它不仅是一堆习题,它首先是一种文化。如果最后,你读到后来,觉得这个化学或物理1500页变成15页了,那就直接奔北大、清华、港大去了。
我讲的一个比较大的话题,为什么要学习平面几何,你不理解它,你对它没有兴趣,这书当然读不好。
我再举个小的例子,为什么要区分电解质的是非强弱。我想你们应该已经知道,化合物它分电解质、非电解质,电解质里面又分强电解质、弱电解质,说强酸、弱酸、强碱、弱碱。昨天,我就在一个学校,碰到了一班非常痛苦的学生,皱着眉头在背这个,是电解质有一条定义,所谓概念;非电解质有一条定义,概念,说是在什么熔化的或者是溶解的状况下,都不导电的叫非电解质,这就两条了。然后是强电解质又有一条概念或者叫定义,弱电解质又来一条,是、非、强、弱四个字,四条嘛,痛苦啊,背不下来啊,背完了以后不知道怎么回事。最痛苦的是在什么地方?我不知道干嘛要去区分这个东西,我花了大力气去分什么叫是,什么叫非,什么叫强,什么叫弱,分到后来,你去问那个学生,为什么要这么分?你以为站在马路上看人啊,过来一个人,甄别一下,哦,这个人属于美女,再过来一个人,再甄别一下,哦,这个人属于丑男,有那么无聊吗?
你首先要搞明白你为什么要去作这种区分,你才可能对它有兴趣,才有可能心甘情愿地花功夫去研究它,这时候再琐碎的东西你也不会觉得很烦。
同学们学到现在有印象了吗?我们化学当中讲的化学反应,研究得最厉害的,最有价值的是什么反应啊?一个叫离子反应对不,有印象吗?点点头。是不是叫离子反应,或非离子反应。
知道《三国演义》开篇,写在扉页上的第一句话是什么?天下大势,那个势,趋势的势,天下大势,分久必合,合久必分,这句话拿到我们化学上来讲,指的就是这个离子反应,就是分分合合,这是第一类,离子反应。
还有一个很重要的反应是什么?氧化还原反应,或者是非氧化还原反应。最重要的就是这两个东西,当然有交叉,一个反应既是离子反应,又是氧化还原反应。
仔细想,我们一天到晚跟谁打交道,要么跟离子打交道。氧化还原反应跟谁打交道?跟电子啊,氧化还原反应的实质是什么?电子得失啊!一天到晚跟离子、电子打交道,离子、电子这两个“子”合在一起,什么东西?都是带电的。
这样理解了以后,那我就知道了,既然我一天到晚在研究这种带电的微粒,一天到晚在研究离子反应,那我当然有必要区分一下谁是愿意电离的,谁是不愿意电离的。哪怕我交一个朋友,我也希望先甄别一下谁是两肋插刀的,谁是鸡毛蒜皮的。你对这个东西要有这个理解,理解了以后就有兴趣,你才会觉得不是那么烦,你会心甘情愿对它花功夫。这也是我说谁笑到最后,是把书越读读薄的同学。
化学反应的基本分类,要么离子反应,要么非离子反应;要么氧化还原反应,要么非氧化还原反应。离子反应跟离子打交道,离子带电的;氧化还原反应跟电子打交道,电子带电。这可能是我个人的观点了,一部化学半部电荷学。现在你理解了吗,为什么要把这个化合物区别成是、非、强、弱(电解质),因为它很重要啊,不得不去区分它呀。在这样一个前提下,你才能够对这门课培养起对它的一种感情,你才可能对它有兴趣,你才可能觉得它不是一种负担。
[PPT]
辩证逻辑与形式逻辑
(不做功、衡压)ΔG=ΔH-TΔS
我刚才已经提了这个问题,为什么要学平面几何,为什么要区分电解质的是、非、强、弱。不怕大家听不懂,我回过头去,再把刚才的熵和能做一个解释。其实,我刚才一直在讲的一句话,叫做“谁的嗓门大”,这句话还是有搪塞的含义在里头。自然科学最终都要走平面几何这条路,都要量化,都要摆事实,讲道理。实际上,现在科学已经发展到这样的一种局面,我介绍一下,热力学已经出来这么一个公式:ΔG=ΔH-TΔS。S还记得吗?熵。我解释一下,这个H,这个字叫焓,讲得粗略一点,就是热,当然它前面有些前提,什么不做功啦,衡压啦,这个我们不懂暂时不管它。大致的讲,粗略的讲,就是热,放热吸热。Δ大家知道的,是变化的意思。这个T是温度,开尔文温度,这个ΔS是熵的变化,增熵或者减熵。所以科学它已经发展到这步,它两项代数和不是我嘴里这么说说的,谁嗓门大,它其实是有具体计算的,算完了以后,这两项代数和,然后看左边那个自由能的变化,我就不解释这个G到底什么意思,你就看自由这两个字,这个自由能的变化,这个自由的程度的变化,然后根据具体数据来判断这个反应是自发的还是不自发的,还是自发以后是很爽快的、非常剧烈的那种自发,它是有具体的数据来计算的。因为大家准备知识不足,我不可能把它解释得更加详细。
[PPT]
化学核心内涵
动态平衡
最后我们来看看化学的核心内涵,你学化学究竟为了什么,你究竟学什么东西。第一个是动态平衡,这是它的价值所在。第二个叫能量最低,这刚才已经解释了,化学反应多半是朝着释放能量的方向来发展的。第三个叫异电相吸,我刚才也已经解释了,一部化学半部电荷学,就是在这种异电相吸啊,同电相斥啊,在这样的情况下面来进行分久必合,合久必分的。当然,各人的理解不一样,譬如说有的老师非常关注的一点是“结构决定性质”,我非常同意这个观点,我只不过是把结构决定性质这一条合并到异电相吸里面去了。这个是我们化学的真正意义所在,我后面用了一个省略号,也就是说各人可以有各人的理解。
最后还是这句话,书要越读越薄,留下一个问题,凭什么把书读薄了?盯着那堆习题,只能把书越读越厚。
今天这课上到这里,谢谢同学们,谢谢大家!

- 全部评论(0)
