关于恒温、恒压条件下化学平衡移动的探讨
时间:2016-05-16 21:20 来源:未知 作者:江已舒 点击: 次 所属专题: 恒压体系 平衡移动
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡理论是中学化学的重要理论之一,也是 教学的重点和难点。恒温、恒压是化学实验和化工生 产中常见的条件,该条件下平衡移动的正确判断对培养和提升学生的辩证观点和化学素养都有重要作用。
1、问题的提出
以 aA(g)+bB(g) dD(g)+eE(g)为例(本文的 反应均指该反应),在恒温、恒容下,对于已经处于平衡状态的该反应,当改变其中任意1种物质的物质的量时,这种改变对平衡移动的影响可以用勒夏特列原理来判断,绝大部分学生也能做出正确的判断。但是,在恒温、恒压下,对于已处于平衡状态的该反应, 同样的改变,还能用勒夏特列原理来判断平衡移动 的方向吗?这种改变究竟是如何影响平衡移动呢?
dD(g)+eE(g)为例(本文的 反应均指该反应),在恒温、恒容下,对于已经处于平衡状态的该反应,当改变其中任意1种物质的物质的量时,这种改变对平衡移动的影响可以用勒夏特列原理来判断,绝大部分学生也能做出正确的判断。但是,在恒温、恒压下,对于已处于平衡状态的该反应, 同样的改变,还能用勒夏特列原理来判断平衡移动 的方向吗?这种改变究竟是如何影响平衡移动呢?
2、问题的分析
化学平衡状态究其实质是V正与V逆相等的状态,当条件发生改变时,平衡移动的方向归根结底取决于条件改变时的相对大小。若条件的改变分别导致V正〉V逆、V正=V逆;V正<V逆,则相对应地,平衡将 分别为向正反应方向移动、不移动、向逆反应方向移动。
在恒温、恒容下,例如增加平衡反应中A(注:也 可以是B、D、E中的任何一种)的物质的量时,因为A 物质的量的增加仅仅造成A物质的量浓度(c(A))变大, 而不会改变其他物质的浓度;又根据教科书中“影响化学反应速率的因素’’可得,c(A)变大必使V正变大,必 导致V正〉V逆,所以平衡向正方向移动;反之,若降低 A的物质的量,平衡将向逆反应方向移动。然而,在恒 温、恒压下,同样改变A的物质的量,根据阿伏加德罗定律或PV=nRT,A物质的量的变化必然导致反应体系总体积的变化。例如,增加A的物质的量,体系的总体积必变大,通过数学计算可得c(A)仍变大,但是, 其他物质的浓度(c(B)、c(D)、c(E)却都变小了!虽然从大学化学可知,对于非基元反应,不可能根据方程式本身来确定参加反应各物质的浓度与反应速率之间的定量关系,但是在其他条件都不变时,若c(A)变大,则V正 随之变大;同理,若c(B)变小,则V正也随之变小;如果同时考虑c(A)变大和c(B)变小这2个对反应速率影响相 反的因素,则V正可能变大、可能变小,也可能不变;与此同时,由于c(D)、c(E)均变小,V逆必然变小。
由上述分析得出,在恒温、恒压下,改变平衡体系 中任意1种物质的物质的量,因为这种改变导致了反 应体系总体积发生了改变,从而导致了V正、V逆 相对大小的不确定性,同时也导致平衡移动的不确定性; 又由于这种改变导致了多种物质浓度发生了变化,相 当于多种影响速率的因素发生了变化,且其中有些因 素对速率的影响是相互矛盾的,所以不能直接用勒 夏特列原理来判断这种改变最终导致平衡如何移动。
3、问题的解决
浓度商Qc与平衡常数K相对大小的比较是解决较复杂平衡移动方向的有效方法。众所周知,对于 给定的反应,平衡常数K仅是温度的函数,T恒定,则 K不变,只要比较条件改变后Qc与K的相对大小,就可以判定该条件的改变是如何影响平衡移动。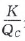 分别等于1、大于1、小于1时,相对应的平衡状态分别 为不移动、向正方向移动、向逆方向移动。在恒温、恒 压下,对于反应 aA(g) +bB(g)
分别等于1、大于1、小于1时,相对应的平衡状态分别 为不移动、向正方向移动、向逆方向移动。在恒温、恒 压下,对于反应 aA(g) +bB(g)  dD(g) +eE(g)而 言,若改变其中任意1种物质的物质的量,是
dD(g) +eE(g)而 言,若改变其中任意1种物质的物质的量,是
不能直 接用勒夏特列原理来判断平衡的移动,仅仅根据方程式的计量系数,能对平衡移动方向做出正确的判断吗?
为了方便解决问题,设反应体系总体积为1 L,当 增加一定量的B(注:也可以是A、D、E中的任何一 种)时,看看该化学平衡是如何移动的。
已知平衡时各物质的物质的量的数值分别为 A0、B0、D0、E0,体系的压强为p,温度为T,不难得出, 混合气体总物质的量的数值n==A0+B0+C0+E0,此时,由于总体积为1 L,故各种物质的物质的量浓度的数值也分别是A0、B0、D0、E0,所以
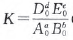 (略去单位).在此T、P条件下,气体摩尔体积的数值为1/n,当向平衡体系加入x mol B物质的一瞬间,A、B、D、E 各物的物质的量分别是A0、B0+x、D0、E0;K保持不 变;根据阿伏加德罗定律或可得出体系的
(略去单位).在此T、P条件下,气体摩尔体积的数值为1/n,当向平衡体系加入x mol B物质的一瞬间,A、B、D、E 各物的物质的量分别是A0、B0+x、D0、E0;K保持不 变;根据阿伏加德罗定律或可得出体系的
总体积由原来的1L变为这时的(x+n)/nL。
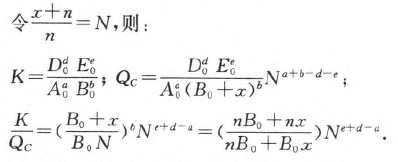
通过进一步的计算和分析可得如下结论:
(1) 当a= d + e时,由于是加入B,故x不可能是负值,又由于 A0+B0+D0+E0=n>B0,(x+n)/n = N>1,所以无论x取任何正值,都是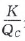 >1,平衡必向正反应方向移动。
>1,平衡必向正反应方向移动。
(2) 当a< d + e时,由于所以无论x取任何正值,都是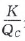 >l,此时平衡必向正反应方向移动.
>l,此时平衡必向正反应方向移动.
(3) 当 a> d + e时,情况较为复杂。当x为某一特 定值(注:不是0也不能是负值)时,会出现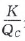 = 1的状况,此时平衡不移动;当x的数值大于此特定值时,
= 1的状况,此时平衡不移动;当x的数值大于此特定值时,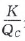 <l,平衡向逆反应方向移动;而当x的数值小于此特定值时,
<l,平衡向逆反应方向移动;而当x的数值小于此特定值时,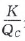 >l,平衡向正反应方向移动。
>l,平衡向正反应方向移动。
如果条件的改变是减少平衡体系中任意一种物质的物质的量,则这种改变对平衡移动的影响可用同 样的方法分析判断。
例方程式为2A(g)+B(g)  D(g),已知平衡时,总体积为1 L,温度为T,压强为p,平衡常数K = 1 L2 mol2 ,各物浓度均为1 mol/L。问:恒温、恒压 下,当向平衡体系加入x mol的B时,平衡如何移动?
D(g),已知平衡时,总体积为1 L,温度为T,压强为p,平衡常数K = 1 L2 mol2 ,各物浓度均为1 mol/L。问:恒温、恒压 下,当向平衡体系加入x mol的B时,平衡如何移动?
解析: 方程式2A + B(g) D(g)可以认为是aA(g) +bB(g)
D(g)可以认为是aA(g) +bB(g)  dD(g) +eE(g)中计量系数 a、b、d、e 别取值为2、1、1、0的情况,显然此时a>d+e,因为总体积为1 L,所以平衡时各物质均为1 mol,且此T、p下气体摩尔体积为1/3mol/L。向体系加入x mol的B,此刻体系总物质的量变为3 + x mol,总体积变为(3+x)/x L,但K的数值仍为1。经化简,得
dD(g) +eE(g)中计量系数 a、b、d、e 别取值为2、1、1、0的情况,显然此时a>d+e,因为总体积为1 L,所以平衡时各物质均为1 mol,且此T、p下气体摩尔体积为1/3mol/L。向体系加入x mol的B,此刻体系总物质的量变为3 + x mol,总体积变为(3+x)/x L,但K的数值仍为1。经化简,得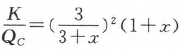 ,令
,令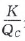 =1,解得x= 3
=1,解得x= 3
当x>3时,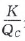 <1;当x = 3时,
<1;当x = 3时,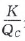 =1;当x<3时,得
=1;当x<3时,得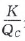 <1。
<1。
所以,当x=3时,平衡不移动;当x>3时,平衡逆向移动;当x<3时,平衡正向移动。
恒温、恒压条件下,对于已处于平衡状态的可逆反应,当改变参加反应的任意1种物质的物质的量时,这种改变对平衡状态的影响比较复杂,不能简单地套用勒夏特列原理,通过比较化学方程式中计量系数的简单大小关系,能方便地判断这种改变是如何影响平衡的移动。

- 全部评论(0)
