如何判断恒温、恒压下改变气体的物质的量时平衡移动的方向?
时间:2021-09-13 15:38 来源:未知 作者:化学自习室 点击: 次 所属专题: 平衡移动
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
众所周知,化学平衡状态是指在一定条件下的可逆反应中,正反应速率等 于逆反应速率(v正=v逆≠0),反应混合物各组分的含量不随时间的改变而改变 的状态。当外界条件(如浓度、压强或温度)发生变化时,化学平衡状态随之发生移动,移动的方向可根据著名的勒夏特列原理进行判断。但目前运用勒夏特列原理判断化学平衡移动方向讨论得最多的是恒温恒容体系,对于能否根据勒夏特列原理对恒温恒压体系平衡移动方向进行判断,存在着不同的意见。 因此对此问题很有必要进行探讨,以期得到更完整的结果。
现以合成氨反应为例进行讨论。
N2(g)+ 3H2(g)  2NH3 (g)
2NH3 (g)
上述反应的标准吉布斯自由能变化ΔGΦ与反应平衡常数KpΦ平衡时气体分压 存在如下关系:
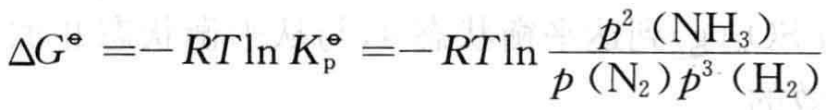 ⑴
⑴
根据道尔顿分压定律,混合气体中气体A的分压pA = xAP, xA为气体A的摩尔分数。(1)式可以写成
![]() (2)
(2)
当体系的条件改变时,平衡被破坏,体系的吉布斯自由能变化ΔG可表示为
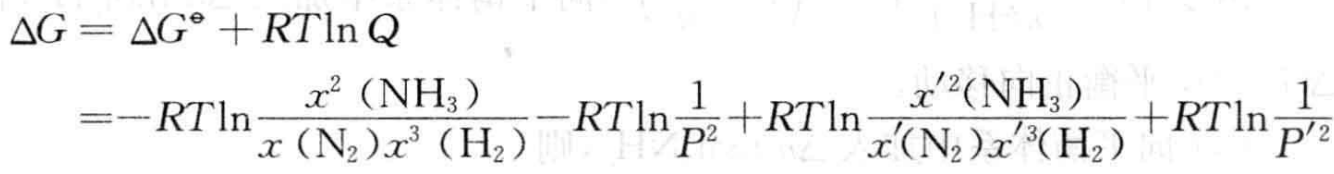 (3)
(3)
式中P、P'分别表示体系条件改变前后体系的总压强。在恒压条件下,根据范特霍夫等温式(3)式可转换成
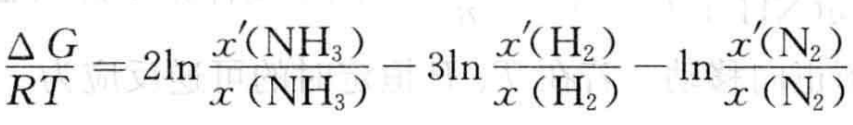 (4)
(4)
设在T、P恒定时,反应到达平衡,若反应物和生成物气体均近似认为 是理想气体,体系平衡时各物质的物质的量分别为n(H2)、n(N2)和 n(NH3)
(1) 向平衡体系中加入Δn mol N2,在加入N2的瞬间,n总=n+Δn[n(N2) + n(H2) + n(NH3)],则
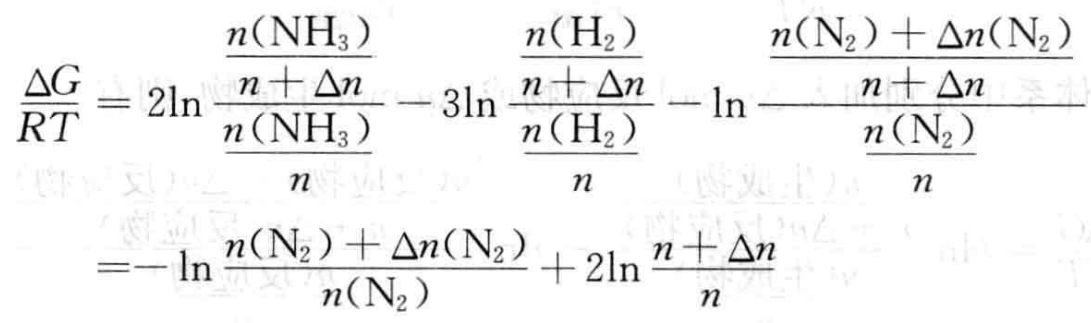 (5)
(5)
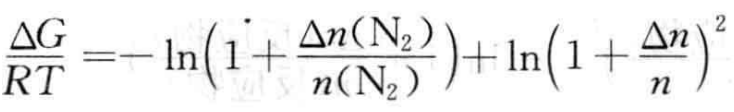 (6)
(6)
若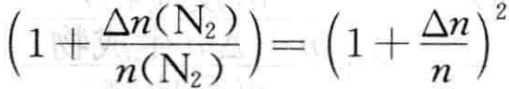 ,ΔG=0,平衡不移动;
,ΔG=0,平衡不移动;
若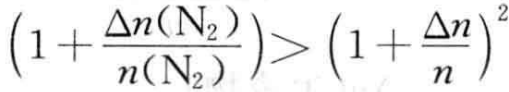 ,ΔG<o,平衡正向移动;
,ΔG<o,平衡正向移动;
若![]() ,ΔG>0,平衡逆向移动。
,ΔG>0,平衡逆向移动。
(2) 向平衡体系中加入Δn molH2
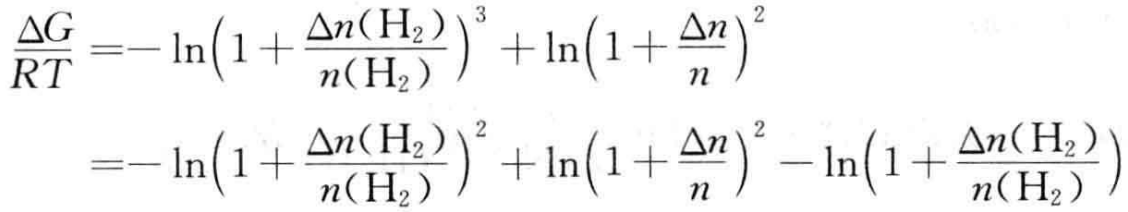 (7)
(7)
由于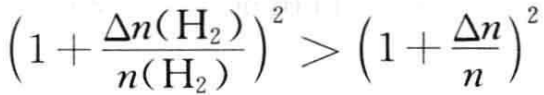 ,向平衡体系中加入Δn molH2,恒有ΔG<0,平衡正向移动。
,向平衡体系中加入Δn molH2,恒有ΔG<0,平衡正向移动。
(3)向平衡体系中加入Δn mol NH3 ,则
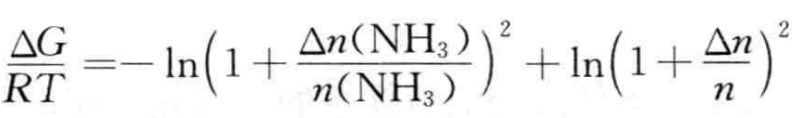 (8)
(8)
由于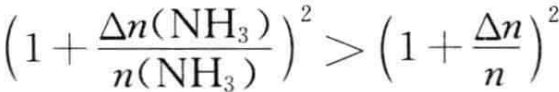 ,向平衡体系中加入Δn mol NH3,恒有ΔG<0,平衡正向移动。若在T、P恒定时的可逆反应:
,向平衡体系中加入Δn mol NH3,恒有ΔG<0,平衡正向移动。若在T、P恒定时的可逆反应:
![]()
设上述反应中生成物和反应物可以是一种或几种气体,反应物和生成物气体均近似认为是理想气体,体系平衡时物质的物质的分別为n(生成物)和 n(反应物),总物质的量为n,体系的吉布斯自由能变化ΔG可表示为:

若向平衡体系中分别加入Δn mol反应物或Δn mol生成物,则有:

增加反应物气体或生成物气体的物质的量,平衡的移动总结如下表:
表2-4恒温、恒压下改变气体物质的量时平衡移动的方向

通过上述讨论,我们可以发现,在恒温、恒压下,向平衡体系中加入气体反 应物,虽然某一种气体的浓度增加(分压增加),但其他组分气体的浓度减小 (分压减小),就必须综合分析这些相反因素对平衡移动的影响,化学平衡还是 向着减弱这些因素改变的方向移动的,并不能说明勒夏特列原理就不适用于 恒温、恒压条件的化学平衡移动的讨论。
参考文献
[1] 王颖霞.勒夏特列原理与合成氨的平衡移动[J].大学化学,2009(5)
[2] 李大塘,郭军.刍议化学平衡移动方向的判断[J].大学化学,2003(1)

- 全部评论(0)
