铁的硫化物性质介绍与比较
时间:2016-06-13 16:36 来源:未知 作者:张扬 点击: 次 所属专题: 二硫化亚铁
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
二硫化亚铁 FeS2
黄色晶体,难溶于水,溶于稀酸。是黄铁矿的主要成分,有反磁性。二硫化亚铁可用于硫酸工业。
1、室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫:
4FeS2+11O2 2Fe2O3+8SO2,2SO2+O2
2Fe2O3+8SO2,2SO2+O2 2SO3,SO3+H2O==H2SO4,主要用于接触法制造硫酸。
2SO3,SO3+H2O==H2SO4,主要用于接触法制造硫酸。
2、中学学习中,Fe为+2价,S为-1价,较为特殊,整个原子团S2为-2价。
FeS2的结构类似于Na2O2,是一种过硫化物,也有叫多硫化物的,与硫反应时生成H2S2,H2S2类似于H2O2,易分解:H2S2==H2S + S 。
因此:FeS2 + 2HCl = FeCl2 + S↓ + H2S↑
如何识别“愚人金”和真正的黄金呢?
只要拿它在不带釉的白瓷板上一划,一看划出的条痕(即留在白瓷板上的粉末),就会真假分明了。金矿的条痕是金黄色的,黄铁矿的条痕是绿黑色的。另外,用手掂一下,手感特别重的是黄金,因为自然金的比重是15.6―18.3,而黄铁矿只有4.9―5.2。还有,放在硝酸里泡一泡,真金是不会冒泡的!
硫化亚铁 FeS
棕黑色块状物;不溶于水,溶于酸的水溶液,同时产生硫化氢;在空气中加热容易氧化,在真空中加热到1100℃以上得到硫。硫化亚铁可由两元素直接反应制得,也可由亚铁盐水溶液与碱金属硫化物作用而得。在实验室中它可用来发生硫化氢 气体;还可用于陶瓷和油漆颜料工业。
1、在空气中有微量水分存在下,硫化亚铁逐渐氧化成四氧化三铁和硫,化学方程式如下:3FeS+2O2=3S+Fe3O4。
2、单质铁和硫密闭高温反应会生成硫化亚铁。
Fe+S→FeS(实验室制取)
3、和氢氧化钠反应
FeS+NaOH→Na2S+Fe(OH)2↓
4、硫化亚铁是反铁磁性的,难溶于水,但可溶于酸放出硫化氢或二氧化硫气体
FeS + 2 HCl→ FeCl2 + H2S↑
H2SO4+FeS→FeSO4+H2S↑ (实验室制取硫化氢)
注:与稀硫酸反应才能制取硫化氢。浓硫酸与硫化亚铁会发生氧化还原反应:2FeS+10H2SO4==Fe2(SO4)3+9SO2+10H2O
5、真空加热至1100 °C时,硫化亚铁开始分解。
6、硫化亚铁的着火点很低,通常在约在50℃以上可以自燃。
三硫化二铁 Fe2S3
黄绿色固体;强热则分解;不溶于水,在热水中分解成硫化亚铁和硫;遇酸分解,放出硫化 体黄铁矿属于金属矿,但工业上主要利用它来制造硫 酸。
Fe3+离子与S2-离子作用的产物,与溶液的酸碱性有关。当Fe3+与(NH4)2S(或Na2S)作用时,生成Fe2S3黑色沉淀,而不是Fe(OH)3沉淀,这是因为Fe2S3比Fe(OH)3难溶(Ksp,Fe2S3=1×10-88,Ksp,Fe(OH)3=1×10-38)之故。如将该溶液酸化,就不会出现Fe2S3沉淀,而得到浅黄色的硫,铁以Fe2+离子的形式存在于溶液中。
Fe2S3 + 4H+ ![]() 2Fe2+ + S↓+ 2H2S
2Fe2+ + S↓+ 2H2S
例题1:分析此反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4 氧化剂、还原剂、氧化产物、还原产物。
解析:
CuSO4中Cu从正二价到正一价,反应中铜离子被还原,作氧化剂。转移14mol电子。(得到电子)
FeS2中S从负一价到Cu2S的负二价,S被还原,作氧化剂,转移电子7mol电子。(得到电子)
FeS2中S从负一价到H2SO4的正六价,S被氧化,作还原剂,转移电子21mol电子。(失去电子)
CuSO4,FeS2是氧化剂,FeS2是还原剂。 Cu2S是氧化产物,H2SO4是还原产物。
例题2:二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明SO42-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
答案:
(1)Fe2+ + S2O32-+S+H2O 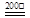 FeS2↓+2H+ + SO42-
FeS2↓+2H+ + SO42-
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s) +11O2(g) = 2Fe2O3(s) + 8SO2(g) △H=-3408kJ·mol-1
[或FeS2(s) +11/4O2(g) = 1/2Fe2O3(s) + 2SO2(g) △H=-852kJ·mol-1]

- 全部评论(0)
