不等性杂化轨道
时间:2021-05-13 16:13 来源:未知 作者:张扬 点击: 次 所属专题: 杂化轨道类型
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
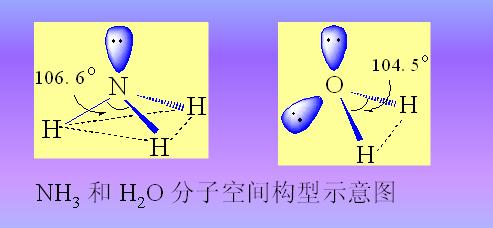
有些分子的成键,表面来看与CH4分子的成键差别很大。比如NH3分子的成键似乎与BF3分子类似,中心原子也将采取sp2杂化的方式成键,键角也应为120°,但实测结果键角却为107°18′,与109°28′更为接近些。又譬如H2O分子的成键似乎与BeCl2分子类似,中心原子也将采取sp杂化的方式成键,键角也应为180°,但实测结果键角却为104°45′,与109°28′也更为接近些。人们经过深入研究认为,在NH3分子和H2O分子的成键过程中,中心原子也像CH4分子中的C原子一样,是采取sp3杂化的方式成键的。
N原子的价层电子构型为2s22p3,成键时这四个价电子轨道发生sp3杂化:

形成了四个sp3杂化轨道。其中三个sp3杂化轨道各有一个未成对电子,一个sp3杂化轨道为一对电子所占据。成键时有三个sp3杂化轨道分别与三个H原子的1s轨道重叠,形成三个N-H键;其余一个sp3杂化轨道上的电子对没有参加成键。这一对孤电子对因靠近N原子,其电子云在N原子外占据着较大的空间,对三个N-H键的电子云有较大的静电排斥力,使键角从109°28′被压缩到107°18′,以至NH3分子呈三角锥形。由于孤电子对的电子云比较集中于N原子的附近,因而其所在的杂化轨道含有较多的s轨道成分,其余三个杂化轨道则含有较多的p轨道成分,使这四个sp3杂化轨道不完全等同。这种产生不完全等同轨道的杂化称为不等性杂化。
至于H2O分子:O原子的价层电子构型为2s22p4,成键时这四个价电子轨道也是发生sp3不等性杂化:

形成了四个不完全等同的sp3杂化轨道,其中二个sp3杂化轨道各有一个未成对电子,其电子分别与二个H原子的1s电子形成两个O-H键;其余二个sp3杂化轨道各为一对孤电子对所占据。这两对孤电子对因靠近O原子,其电子云在O原子外占据着更大的空间,对两个O-H键的电子云有更大的静电排斥力,使键角从109°28′被压缩到104°45′,以至H2O分子的的空间结构如下图。

- 全部评论(0)
