烷烃燃料电池电极反应式的书写
时间:2017-09-18 17:21 来源:未知 作者:唐明再 点击: 次 所属专题: 烷烃 燃料电池 电极反应式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
碱性条件下的甲烷燃料电池:CH4+2O2+2OH-=CO32-+3H2O
这里要先学习燃料电池中一个基本规律:氧化剂氧气得电子,直接结果是生成O2-,但是,如果是水溶液中,则O2-不能稳定存在。在酸性条件下,O2-+2H+=H2O(回忆并比较:Na2O+2H+=2Na++H2O),在中性或碱性条件下,O2-+H2O=2OH-。(回忆并比较:Na2O+ H2O =2Na++2OH-)
结合上述规律运用“四步法”写甲烷燃料电池的电极反应就很容易了:第一步,写出总反应
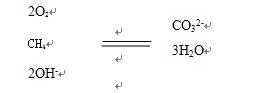
第二步,写出氧气得电子情况,2O2+8e-。 根据电子守恒,不需要分析甲烷化合价变化可直接写出:CH4-8e-
第三步,碱性条件下,氧分子得电子后与水作用生成OH-,故写出2O2+8e-+4H2O=8OH-,根据原子守恒,在反应物这边下面部分写上“-4H2O”,在生成物下面部分写上“-8OH-”。
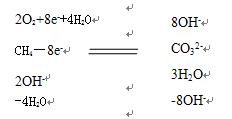
第四步,圈出正极反应式:2O2+8e-+4H2O=8OH-
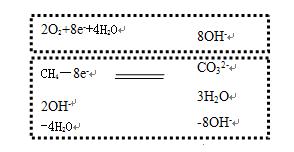
剩下部分就是负极反应式,注意要移项,将微粒符号前为负号的移项到另一边即可:
负极反应:CH4-8e-+10 OH- = CO32-+7H2O
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(3461692232) 评论 href="/plus/view.php?aid=16580">烷烃燃料电池电极反:哇哦,挺有用的,一看就懂了
还没有评论,快来抢沙发吧!
