电解亚硫酸钠、氯化亚铁、氯化铁、锰酸钾溶液
时间:2018-01-18 10:31 来源:未知 作者:吴文中 点击: 次 所属专题: 放电顺序 电解原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.电解Na2SO3溶液
【分析】溶液中存在的离子有H+、OH-、Na+、SO32-.简单分析就是要比较H+和Na+得到电子的能力以及OH-和SO32-失去电子的能力,显然产物应该分别为氢气和硫酸根离子。方程式为: Na2SO3 + H2O = Na2SO4 + H2
【讨论】假如得到氧气,则氧气也能和亚硫酸根离子作用得到硫酸根离子,况且这里的氧是新生氧,具有 “很强的生命力”。
附:酸性条件下氧气的还原电位是+1.229V;硫酸根和亚硫酸之间的还原电位是+0.17V。算了一下,要得到氧气出现需要pH=0(氢离子浓度为1mol/L)时亚硫酸浓度低于十的负36次方才有可能。
【延伸】假如这里具有强还原性的离子不是阴离子,又会怎样?因为在电场的作用下,阳离子是往阴极移动的,使得阳极附近的阳离子浓度降低,影响阳离子的还原性,而在阴极的发生的还原反应,譬如,氯化亚铁溶液就存在这个问题。
二.电解FeCl2溶液
【分析】这里的问题就是刚才提出的问题,亚铁离子在电解时,会“慢慢”移动到阴极,但毕竟比较少,但不管怎样,在阳极即便得到氯气,生成的氯气也会和亚铁离子作用得到铁离子,理论分析,电解氯化铁一定会使得溶液先变黄色,阴极产生气体,甚至可以得到氢氧化铁沉淀,阳极产生的气体是否能被完成反应掉?是否有氧气产生?这些有待实验证明。笔者以为,该实验和浓度以及酸碱度有关。
实验结果(电解10分钟):在阴极产生的气体明显比阳极要多,至少要2倍以上,用湿润的KI淀粉试纸没有检出Cl2,也没有感觉到的刺激性气味。随着电解时间的增加,阳极的溶液颜色不断加深,从浅绿色变化为黄色,黄色溶液不断向阴极扩散。阴极附近没有产生白色或者灰绿色的沉淀(可能电解时间较短)。
三.电解FeCl3溶液
实验现象:阳极与阴极都产生了气泡,但是阳极产生气体的体积约是阴极产生气体的3倍。阳极产生的气体有强烈的刺激性气味。电解质溶液颜色变化不明显。
分析结论:
阳极Cl-放电生成Cl2。
阴极则是Fe3+与H+同时放电,H+反应程度更大一些。
很明显,以上两种情况出现了矛盾。原因就是两者的浓度有显著的不同,这里也说明了粒子的氧化性或者还原性显然和浓度关系比较大。
四.电解K2MnO4溶液
工业上采用铁和石墨为电极,电解K2MnO4溶液制取KMnO4。
(1)电解时,应以__________作阴极,电解过程中,阴极附近溶液的pH将会____________(填增大、减小或不变)。
(2)阳极反应式为_____________________________________。
(3)电解的总化学方程式为_____________________________。
答案:
(1)铁 增大
(2)MnO42--e- = MnO4-
(3)2K2MnO4+2H2O =2KMnO4+2KOH+H2↑
注:氢氧根失电子,形成羟基自由基,亚铁离子或者铁离子能与羟基自由基发生feton反应(终产物为Fe2+),使之分解为水和氧气.
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)naHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 __________(填化学式)。
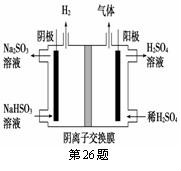
在这种情况下,由于亚硫酸氢钠并不是在阳极区,因此难以失去电子,则在阳极得到氧气,并同时得到二氧化硫!

- 全部评论(0)
