剪不断理还乱的锌与氯化铁溶液
时间:2019-01-03 15:33 来源:未知 作者:吴文中 点击: 次 所属专题: 氯化铁
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
存在多个相互竞争的反应体系中,存在如下事实:
(1)当相互竞争的几个平行反应的反应速率相差无几时,反应产物的多寡取决于反应的平衡常数的大小(热力学主导),平衡常数越大则其产物的量越多;平衡常数差异非常显著时,反应才能近似看作有先后顺序,平衡常数大的那个化学过程首先发生反应;
(2)当相互竞争的几个平行反应反应速率相差较大时,发生的主反应并不一定是热力学(平衡常数大小)决定,而是由动力学(反应速率)驱动。
从下列数据可知:锌与铁离子之间的标准电动势为1.534V; 锌与氢离子之间的标准电动势0.763V;锌与亚铁离子之间的标准电动势为0.323V。即仅从热力学上看,铁首先会与铁离子反应,然后与氢离子,最后轮到锌与亚铁离子之间的作用!
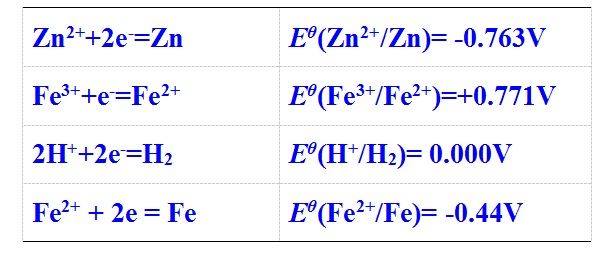
如金属与硝酸反应的产物有多种热力学可能性,其中Eθ(NO3-/NO2)=0.80V,Eθ(NO3-/NO)=0.84V,Eθ(NO3-/N2)=1.25V等,从热力学角度上看,这里可以发生3个反应,我们能仅通过平衡常数来判断反应的先后吗?
比较上述3个热力学数据得知:某金属(如Cu等)与硝酸反应的还原产物为N2时的平衡常数是最大的,反应完全程度是最大的,那是不是就可以判断铜与硝酸反应得到的是氮气呢?事实上,Cu与浓硝酸(12~16mol·L-1)反应产物主要是NO2,与稀硝酸(4~8mol·L-1)反应产物是NO,Eθ(NO3-/N2)=1.25V尽管最大,但不表明被还原产物是以N2为主。
以上叙述很重要,再来看看动力学上的竞争反应
可怜的铁离子——被水围着!
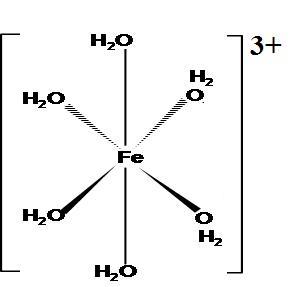
氢离子在水溶液中行为
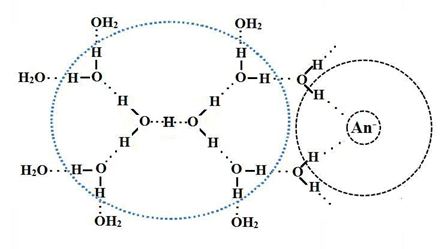
这是一元酸在水溶液中的复杂行为、看到氢键了吗?
水合氢离子和氢氧根离子在水溶液中的传导示意图
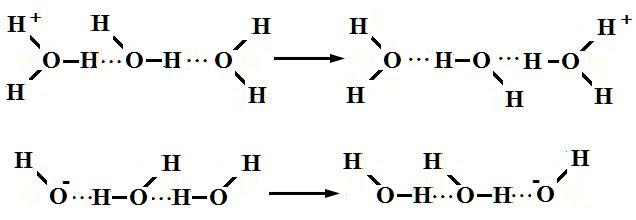
换句话说,氢离子和氢氧根离子随时都能到岗、哪里有需要就会出现在哪里!
综上,可得出如下结论:当锌与氯化铁溶液混合后,金属锌可以随时“遇到”氢离子,而难以遇到真正的铁离子,这是因为尽管铁离子浓度大于氢离子浓度,但由于铁离子一方面水解为其他复杂离子,另一方面又被水分子、氯离子等包围着,而氢离子却能通过快速的“氢键断裂与氢键形成”以特殊的传导方式不断来到金属锌表面,因此,从微观的动力学上看,金属锌遇到氢离子的几率远远大于遇到铁离子的几率,当然,金属锌表面也会有铁离子存在,因此发生金属锌与铁离子之间的反应也存在着。
仔细看这一段喔
来做些实验先
[实验1]在未用盐酸酸化的0.5mol/L氯化铁溶液中,加入锌粒后静置,刚开始无明显气泡,1~2min后,可见气体产生,一段时间后,溶液颜色变深,存在丁达尔现象,往混合溶液中滴加铁氰化钾溶液后,可见蓝色沉淀。
[实验2]在三支盛有未用盐酸酸化的0.5mol/L氯化铁溶液中(分别标记为①②③),在②③试管中加入过量铁粉后,其中②不振荡静置,③试管震荡后静置,一段时候后,现象如图4(a),稍稍振荡②试管,现象如图4(b)。
振荡与不振荡的差异是明显的

[实验3]在未用盐酸酸化的0.5mol/L氯化铁溶液中加入锌粒,然后室温(18℃)与65℃水浴下进行对比试验如图4(c),图4(c)右为水浴加热,半分钟后,观察到水浴中产生氢气快得多,溶液颜色很快转化为红棕色,取出未完全反应的锌粒,加入锌粉长时间振荡,发现红棕色显著变浅。
温度对反应的影响也是明显的
[视频1]
常温,振荡
[视频2]
水浴加热
[视频3]
常温,不振荡
锌与纯氯化铁溶液反应,得到亚铁离子是很容易检验的,您知道那个蓝色沉淀是什么的!

上述试验充分说明,竞争反应不能仅依据热力学数据判断,微观的动力学化学过程反而驱动了化学过程。对于金属锌与氯化铁溶液间的作用可作如下分析,锌与氯化铁溶液的体系中,可能发生的过程如下:
Zn+2H+=Zn2++H2↑(快); Zn+2Fe3+=Zn2++2Fe2+(慢); Zn+Fe2+=Zn2++Fe。
上述的3个反应过程中,当铁离子与氢离子浓度相同的情况下,铁离子优先与金属锌反应的结论是建立在热力学驱动的前提下的,此时,上述3个反应的快慢我们并没有加以考虑,假如锌与氢离子反应是快速的,那么氢离子与铁离子同时与金属Zn反应是不难想象的。随着反应的进行,氢气的逸出有利于Zn与氢离子的持续发生,而Zn与铁离子之间的反应由于微观的动力学特点反而使反应速率变得不高,说得通俗一点就是把金属锌放到氯化铁溶液中,锌释释出的电子既可以被铁离子得到,也可以被氢离子得到,当氢离子得到电子变成氢气后就“跑到”反应体系之外了,即便铁离子得电子能力很强,但由于氢气已经离开了反应体系,使得铁离子眼巴巴地看着氢离子得到电子变成氢气跑掉而“望洋兴叹”了,退一步说,即便氢气留在反应体系中,铁离子也难以与氢气之间发生氧化还原反应,这是因为液相与气相间的反应速率往往是慢反应,刘怀乐先生曾设计实验验证了氢气难以与硫酸铜、硝酸银溶液反应的事实,尽管氢气的还原性大于金属铜和银。
化学反应往往是很复杂的,就一个简单的锌与氯化铁溶液间的过程,会因为浓度、温度或接触方式不同而产生不同的现象,但其化学过程的本质特征并没有变化。
化学学科之属性,其根本就是化学学科的核心素养。
那么,锌与氯化铁溶液反应能否得到金属铁?当然,只是量的多少而已!各类文献实际上已经说得很清楚!

- 全部评论(0)
(2080667802) 评论 href="/plus/view.php?aid=17086">剪不断理还乱的锌与:看完了,感谢
