影响分子中键角大小的因素
时间:2020-04-07 16:05 来源:化学原理补正博客 作者:伍伟夫 点击: 次 所属专题: 键角
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键角为某原子,与另两个原子所成共价键间的夹角。是表示分子空间构型的基本参数之一。虽然比较键角的大小也是无机化学教学中分子结构部分的一个重要教学内容,但由于要全面地解决该问题,会涉及分子结构的诸多知识,所以不但在一般的无机化学教材没有讨论过这个问题,甚至在一些《无机化学解题指导》、甚或是一般的结构化学类书籍中也找不到关于这个问题的较系统的答案。
其实,要讨论清楚这一问题,只需要一些并不复杂的化学常识。
一、中心原子杂化类型对键角大小有决定性的影响
中心原子采取不同的杂化形式时,其等性杂化轨道的空间分布情况及杂化轨道之间的夹角是各不相同的。这是决定键角大小的最根本的原因。
由杂化理论很容易得到如下的结果:
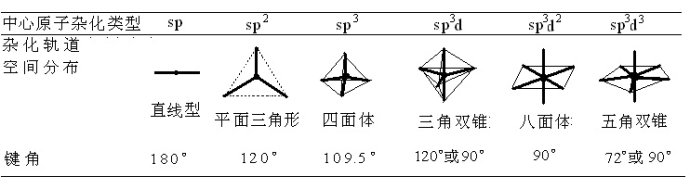
所以,比较分子中键角的大小,第一步就是用价层电子对互斥理论来判断其中心原子的杂化类型。上表的由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
当然,对于后3种杂化类型(总配位数大于4的分子或离子)来说,情况要稍微复杂一些。还要考虑孤对电子的分布情况,以判明各原子的相对位置、清楚所讨论夹角究竟是由哪两个具体的共价键构成的。
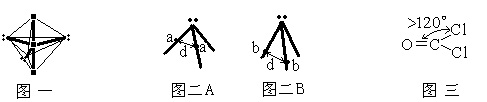
例2,XeF2分子或I3-离子,中心原子的总配位数都是5,采取的都是sp3d杂化,还都各有3个孤电子对。在5个杂化轨道中,位于三角锥形腰部的3个杂化轨道都要被孤对电子占据,这样,两个配原子(其余的F或I)只能分别位于三角双锥两个相对的顶点(如下图一所示)。这样∠F-Xe-F及∠I-I-I都只能为180°,而不可能是90°或120°。
二、中心原子孤电子对数目对键角的影响
在中心原子杂化类型相同时、由于其配原子的个数可能不同,也就是孤电子对数目会有区别,这时键角也会是有区别的。
这是由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。且中心原子的孤电子对数越多,键角会变得越小[2]。
例3,
键角
在这一系列NX3分子中,N原子均为sp3杂化,N原子都是以共价结合了3个原子(或原子团),都有一个孤电子对。所以它们的∠X-N-X键角都约为109.5°,并均略小于该数值。说明孤电子对排斥其他键对电子的作用是十分显著,且一致的,N原子均为不等性sp3杂化。
例4,对H2O、NH3、CH4分子系列。这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。其孤电子对数分别为2、1、0.。在H2O分子中,键角要受2个孤电子对的压缩,键角应该会最小。这就导致出推断:该序列是一个键角逐渐增大的序列。作为验证,可查得它们的键角分别是104.5°、107.1°、109.5°。
三、配原子电负性对键角的影响
当中心原子种类相同(同一种原子)、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
更形象一些,可以用示意图表示出来,当两成键电子对的排斥距离差不多相当(都为D时)时,成键电子对距中心原子核距离近(图二A)会造成键角变大。而成键电子对距中心原子核距离远(图二B)会造成键角变小。
例6,将NF3与NH3比较,中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更远(相当于图二B),两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。
一个与其相关的现象也很有意思。在NF3中成键电子更靠近F原子除了造成键角与NH3分子不同外,还使分子的极性发生了改变。实测的NH3分子偶极矩为1.5D,而NF3分子仅为0.2D。
对此可以解释为:在NH3分子中,由于N原子上有孤电子对,N原子一端带有较多的负电荷,同时N-H键的成键电子对也靠近N原子(N原子的电负性大)),这是造成NH3分子有较大偶极矩的根本原因。而在NF3分子中,N-F键的成键电子对离N原子要远些,虽然可以使N原子的孤电子对占据更大的空间,但N-F成键电子对离F原子终归是更近了,从而抵消掉部分的孤电子对对分子极性的影响,使整个分子的负电荷重心从N原子一端向F原子端偏移一些,从而使分子的偶极矩减小。
对常遇到的H2O与OF2分子的键角和极性比较,也可以比照上例来进行判断。
四、中心原子电负性对键角的影响
当.中心原子种类不同(同主族),但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。反之,中心原子电负性小的分子,成键电子对要远离中心原子,成键电子对间的斥力要变小,键角要变小。
例7,比较典型的例子是H2O与H2S的键角。通常认为其中的O与S原子都采取了sp3杂化,都有2个孤电子对。但O原子的电负性大,键角应该比H2S中的键角大
五、单键与重键对键角的影响不同
在同一个分子中,与单键相比较重键的成键电子数目要多一些,对另一单键电子对的斥力也要更大些。重键的存在,可以使与其相邻的由单键组成的键角变小。
例8,在COCl2分子中,C原子为sp2杂化。虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以。∠O-C-Cl键角要大于∠Cl-C-Cl键角(如图三)
六、孤电子与孤电子对对键角的影响不同
奇分子(有成单电子的分子)是很少遇到,但有可能遇到的一种特殊的分子。由于奇分子的中心原子有一成单的孤电子,与组成和它基本相同、只是比它多一个电子的物种来比较,成单电子对成键电子的排斥力应该是小于孤电子对-成键电子对间的排斥力的。
例5.比较NO2+、NO2、NO2-物种中∠O-N-O键角的大小。可以采用如下的表格来帮助我们的分析。
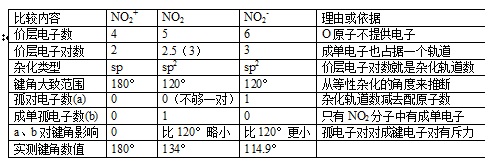
也就是说有NO2+、NO2、NO2-的∠O-N-O键角依次减小的顺序。
实测数据也证明了这一点。但另人意外的是:NO2的键角不但不比120°小一些,还比120°大了许多。
看来,对相邻电子对间斥力大小的比较,不应该仅有:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。还应再补充上一部分“>成单孤电子-成键电子对”。这样的序列才算完整。
七、配体体积对键角的影响
当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用。
如上面的例3中的NH3、·NH2OH、NH2(CH3),∠H-N-H键角依次减小。而对NF3与NF2(CH3),也是后者的∠F-N-F键角更小。
这似乎说明体积更大些的(CH3)的排斥成键电子对的能力要强于(OH)、更强于H原子;说明(CH3)的排斥成键电子对的能力甚至于要强于F原子。
八、比较键角大小的方法
从上面几方面的比较可以看出,这几个影响键角的因素都是有条件的,在影响键角的能力方面也是有区别的。
在一般情况下,应该先从中心原子的杂化类型来入手。因为杂化类型决定了分子的基本构型。
在中心原子杂化类型相同的情况下,次之的就是,应从孤对电子的数目来考虑问题。判断的依据是:孤电子对-成键电子对间的斥力>成键电子对-成键电子对间的斥力>成单孤电子-成键电子对间的斥力(当有奇分子参与键角比较时,就需要用该序列的最后一部分)。
在中心原子杂化类型相同,且孤对电子数目也相同时,再用中心原子或配原子的电负性不同来分析。
在同一分子中,应考虑双键的影响。
配体基团较大的情况不常遇到。本人也未注意到更多的类似事例。仅从上面的例子看,似乎其影响比电负性的影响还要显著些。

- 全部评论(0)
(994950894) 评论 href="/plus/view.php?aid=17311">影响分子中键角大小:挺好,有用
