有关书写大π键表达式的一点经验
时间:2019-05-28 08:13 来源:未知 作者:化学自习室 点击: 次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
HMO法认为形成离域大π键的条件为:
(l)形成离域大π键的原子均在同一平面上;
(2)p电子数必须小于p轨道数的两倍。怎
样正确写出某个离域大π键的πmn表达式呢?下面谈谈自己的一点休会。
步骤:
(l)判断该分子有无形成大π键的可能,并确定n值;
(2)将有关原子间以短线相连;
(3)计算最外层电子数及剩余电子数(同时考虑电荷);
(4)检查有无未配对电子,并计算m值。
例如:CO32-
(l)判断可能性:根据价电子对互斥理论,碳原子周围有3对价电子,即CO32-是平面三角形结构,碳原子的三个sp2杂化轨道分别与三个氧原子形成三个σ键,还剩下一个p轨道,三个氧原子均有一个与之平行的p轨道,即CO32-有形成离域大π键的可能,且n=4
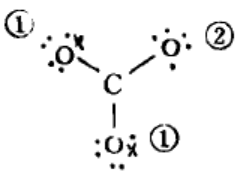
(2)短线连结有关原子:

(3)计算电子数并排布电子
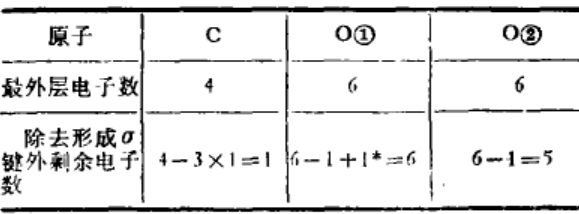
排布:
(4)检查有无未配对电子:
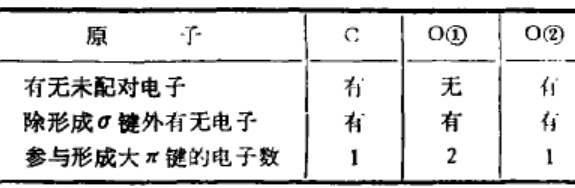
l×l+2×2+l×1=6
即CO32-中离域大π键的表达式为π64
说明:(l)由于杂化的原因,在书写过程中必须同时考虑s、p轨道;
(2)若是离子,则应在体系中某几个原子上增减与电荷数相等的电子数(正减负加;)
(3)对于无未配对电子的原子,若除形成以短线表示的σ键外有剩余电子,应有2个电子参与离域大π键的形成;若有单个电子则此电子参与成键;
(4)用此法书写π表达式不必考虑配位键的单向供电子性,因为这对整个分子体系的电子数无影响.
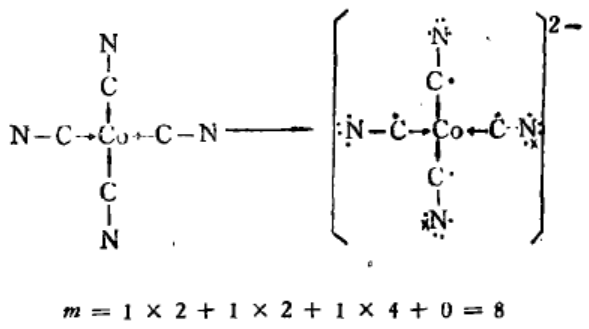
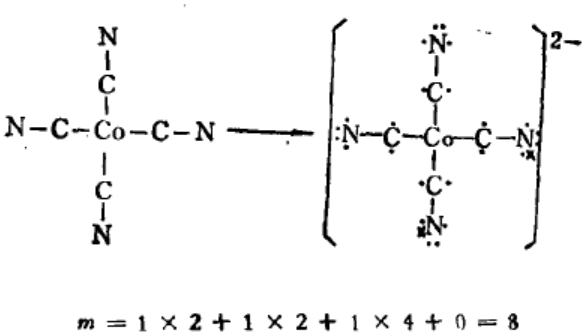
如CO(CN)42-用两种方法计算均得π89同一结果;
考虑配位键:
不考虑配位键:


(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
田野(2585395999) 评论 href="/plus/view.php?aid=17314">有关书写大π键表达式:真好,学会了
还没有评论,快来抢沙发吧!
