乙醛的氧化反应实验说明
时间:2019-11-13 09:09 来源:未知 作者:化学自习室 点击: 次 所属专题: 乙醛 银镜反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、与Tollens (托林试剂)反应
CH3CHO+2 [Ag(NH3)2]++ 2 OH- CH3COO-+2 Ag + NH4++H2O + 3 NH3
CH3COO-+2 Ag + NH4++H2O + 3 NH3
此实验反应又名银镜反应
①Tollens 又名银氨溶液
Ag+ +NH3·H2O=AgOH+NH4+
AgOH+2 NH3 • H2O = [Ag(NH3)2]++OH-+2 H2O
②银氨溶液配制操作要领及现象
A. 2%稀氨水向1毫升2%硝酸银溶液中滴加;
B. 出现棕黄色浑浊;
C.恰好使沉淀溶解即停止滴加,勿过量。
③银镜反应实验要领
A. 滴加醛,混匀后水浴加热,温度60℃左右;
B. 加热过程中切勿振荡,如2分钟后仍未出现银镜,可用玻 璃棒在试管内壁轻轻摩擦;
C. 实验结束必须立即处理反应后溶液,银镜可用少量硝酸除掉。
④银氨溶液必须随配随用,不可久置,否则会生成易爆物质 Ag3N (可能有 Ag2NH)。
⑤为什么不用硝酸银溶液直接氧化醛而要用银氨溶液? 硝酸银为强酸弱碱盐,因银离子部分水解而使溶液显弱酸性。
溶液中,标准电极电势为:
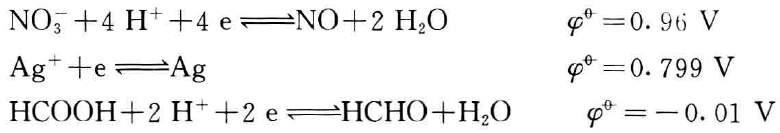
(供比较用)
而在银氨溶液中.溶液显弱碱性,标准电极电势为:
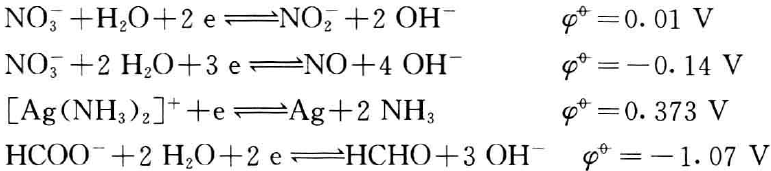
(供比较用)
比较而言,碱性条件下,醛还原能力增强;在银氨溶液中,对 NO3-不利,而有利于醛将[Ag(NH3)2]+还原而产生银镜。
二、与Filling(费林)试剂的反应
CH3CHO + 2 Cu(OH)2 + OH- CH3COO-+ Cu2O(红色)+ 3H2O
CH3COO-+ Cu2O(红色)+ 3H2O
①氧化实验
A. 配制Filling(费林)试剂
将4〜6滴酸铜溶液滴加到2%氢氧化钠2毫升溶液中,振荡均匀;氢氧化钠溶液必须过量。
B. 加热煮沸(加快化学反应速度)
C. Cu(OH)2 + 2 NaOH=Na2[Cu(OH)4](络合物)
②若有乙酸,反应为2CH3COOH + Cu(OH)2 Cu(CH3COO)2 + 2 H2O(蓝色 溶液)
Cu(CH3COO)2 + 2 H2O(蓝色 溶液)
所以,要求碱过量。
③若是多羟基醛,如葡萄糖,加热过程中,会呈现绛蓝色溶液。
④为什么Cu(OH)2需要新配置?要求NaOH过量?
2 Cu(OH)2 + 2 e- Cu2O + 2 H2O+2 OH-
Cu2O + 2 H2O+2 OH- ![]() =-0.08 V
=-0.08 V
由于Cu(OH)2溶解度小,氧化能力弱,_而新配制的溶液中,利 用Cu(OH)2的两量强碱将Cu(OH)2转化为溶解度较大的 Na2 [Cu(OH)4](络合物),从而利于实验的成功;NaOH过量,使 乙醛在碱性溶液中的还原能力远强于在酸性或中性溶液中的还原 能力(参考上述甲醛的电极电势);NaOH过量还可中和产生的乙 酸,避免在反应过程中Na2[Cu(OH)4]被乙酸中和。

- 全部评论(0)
